|
 |
- Search
| J Korean Med Assoc > Volume 56(11); 2013 > Article |
Abstract
Sorafenib, as the first approved molecularly targeted agent for hepatocellular carcinoma (HCC), has changed the treatment paradigm for patients with advanced HCC. Although a significant survival advantage has been achieved with sorafenib, the prolongation of survival is modest, even in the cases of Child-Pugh class A. Because of primary resistance and secondary resistance, the anti-tumor effects of sorafenib are limited in a portion of HCC patients. To overcome these limitations of sorafenib, various molecularly targeted therapies have been studied alone or in combination with each other, and also adjuvant to other modalities. The role of sorafenib as an adjuvant or neo-adjuvant therapy needs to be evaluated before and after surgery and locoregional therapies. Because patients with HCC are a highly heterogeneous population in terms of molecular pathogenesis and in terms of the natural course of their disease, development of biomarkers of a response before or during sorafenib treatment and development of other molecularly targeted therapies is imperative for selecting prospective good responders. New agents under development target and block VEGF, VEGFR, PDGFR, FGF, FGFR, EGFR, PI3K/Akt/mTOR, IGFR, MEK, c-MET, glypican-3, JAK2, PD1, CTLA-4, etc. The advent of targeted systemic therapies for advanced HCC may have important implications for the future management of patients with advanced HCC, including a need for improved assessment of disease progression, reliable biomarkers for patient selection, and the use of a multidisciplinary approach.
진행성 간세포암종(advanced hepatocellular carcinoma)은 근치적 치료가 어려워, 전신항암요법(systemic chemotherapy)을 비롯한 여러 가지 치료가 시도되어 왔다. 세포독성 화학요법(cytotoxic chemotherapy)은 오래 전부터 쓰여왔으나, 무작위대조군 임상연구(randomized controlled clinical trial, RCT)에서 전체 생존율(overall survival)향상이 입증된 약제는 아직까지 없다. 2008년에 비로소 3상RCT에서 경구용 표적치료제인 sorafenib이 진행성 간세포암종 환자의 전체 생존율을 향상시킨다고 보고되었고[1], 이러한 연구를 바탕으로 sorafenib은 현재 진행성 간세포암종의 1차치료제로 권장되고 있다[2]. 하지만, 생존 향상의 정도가 중양값 3개월 전후로서 실제 임상에서 기대하는 수준에 미치지 못하여 이를 향상시킬 수 있는 새로운 방법과 약제의 개발이 절실한 상황이다.
Sorafenib은 혈소판유래 성장인자 수용체(platelet derived growth factor receptor), raf 키나제(raf kinase), 혈관내피 성장인자 수용체(vascular endothelial growth receptor)등에 작용하는 다중 키나제 억제제(multiple kinase inhibitor)로[3] 간세포암종에서는 최초로 승인된 표적치료제이다.
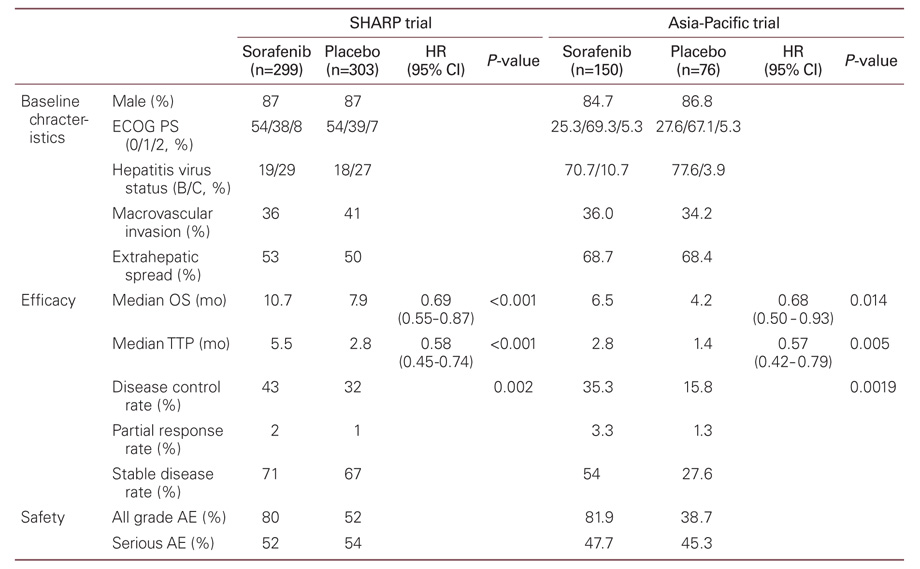
유럽, 미주 지역을 중심으로 이루어진 다기관, 무작위배정, 이중맹검, 위약대조 3상연구(Sorafenib Hepatocellular Carcinoma Assessment Randomized Protocol, SHARP trial)는 이전에 전신항암요법을 받은 적이 없고 Child-Pugh class A인 602명의 진행성 간세포암종 환자를 대상으로 하였다. Sorafenib을 복용(400 mg 하루 2회 경구)한 환자에서 중앙생존기간(median overall survival)은 10.7개월로 위약대조군의 7.9개월에 비교하여 2.8개월 연장되는 통계적으로 유의한 결과를 보였고(상대 위험도[hazard ratio] 0.69, 95% 신뢰구간 0.55-0.87, P<0.001) [1], 1년 생존율은 sorafenib군에서 44%, 위약대조군에서 33%이었다(Table 1). 영상검사에 근거한 무진행 생존기간(time to radiologic progression)은 sorafenib군에서 5.5개월, 위약대조군에서 2.8개월(상대 위험도 0.58, 95% 신뢰구간 0.45-0.74, P<0.001)로 역시 유의한 연장효과를 보였다. 질병 조절률(disease control rate)은 RECIST (Response Evaluation Criteria in Solid Tumors) 기준에[4] 근거하여 완전관해(complete response)이나 부분관해(partial response), 안정질환(stable disease)을 보인 경우인데, sorafenib군과 위약대조군에서 각각 43%와 32%로 유의한 차이를 보였으나 (P=0.002), 안정질환을 보인 경우가 대부분으로 완전관해를 보인 경우는 없었고, 부분관해를 보인 경우는 양 군 각각 2%와 1%로 전반적으로 낮은 반응률을 보였다. 전체적인 부작용 발생 빈도는 sorafenib 복용군에서 80%, 위약대조군에서 52%를 보였다. Sorafenib군에서 발생한 치료관련 부작용은 주로 설사(39%), 피로감(22%), 수족증후군(21%) 등으로 주로 1-2단계이었으며, 3단계 이상을 보인 경우는 설사(8%), 수족증후군(8%), 피로감(3%)이었다.
중국과 우리나라를 포함한 아시아-태평양 지역에서 시행된 3상연구(Asia-Pacific trial)에서는 이전에 전신항암치료를 받은 적이 없는 Child-Pugh class A인 진행성 간세포암종 환자 226명이 sorafenib 혹은 위약대조군에 배정되었다(2:1 배정)[5]. 중앙생존기간은 sorafenib 투여군에서 6.5개월, 위약대조군에서 4.2개월로 유의한 생존 연장 효과를 보였다(상대위험도 0.68, 95% 신뢰구간 0.50-0.93, P=0.014). 무진행 생존기간은 sorafenib 투여군에서 2.8개월, 위약대조군에서 1.4개월로 역시 유의한 차이를 보였다(상대위험도 0.57, 95% 신뢰구간 0.42-0.79, P=0.0005)(Table 1). 치료연관 부작용은 수족증후군(45%), 설사(25.5%), 탈모(24.8%), 피로감(20.1%) 순으로 발생하였다. 아시아지역 연구에서는 전반적인 생존기간이 이전의 연구(SHARP trial)에서 보다 짧았는데, 이전 연구와 비교하여 대상 환자에서 비교적 간외 전이가 많이 동반되었고, ECOG 전신 수행 상태(Eastern Cooperative Oncology Group performance status)가 좀 더 나빴던 점, 또한, 활동성 B형간염동반 환자가 더 많았던 점 등이 나쁜 결과의 이유로 추정된다. 그러나 동서양의 두 연구 모두에서 sorafenib군의 생존율 상대위험도가 각각 0.69, 0.68로 거의 동일하게 낮았다는 점이 sorafenib의 일관된 효과를 반영한 것으로 보인다. 단일 기관에서 sorafenib 치료를 6주 이상 받았던 351명을 대상으로 한 후향적 연구에서 전체 생존기간은 중앙값이 9.4개월이었고 무진행 생존율 중앙값은 4.1 개월이었는데, 10개월 이상의 무진행 생존을 보인 경우는 48명(13.7%)이었다[6].
반응 예측 인자를 살펴보면, SHARP 연구에서는 육안적 혈관침범이 있거나, 간외 전이가 없는 경우 sorafenib 치료에 대한 반응이 양호한 것으로 보고하였다[1]. 이후에 발표된 후속연구를 살펴보면, 간세포암종의 원인이나, 육안적 혈관침범/간외전이 여부, ECOG 전신 수행 상태, BCLC 병기(Barcelona Clinic Liver Cancer stage) 및 이전 치료력에 따라 하위집단분석을 하였는데, 하위집단에 상관없이 전반적으로 sorafenib군에서 중앙생존 기간이 높은 양상을 보였다[7]. 이 중 HCV 항체 양성인 환자에서 위약대조군에 비교하여 sorafenib 복용군에서 중앙생존기간이 유의하게 두드러진 차이를 보였다(14개월 vs. 7.4개월, 상대위험도 0.5, 95% 신뢰구간 0.32-0.77). 또 다른 후속 연구에서 치료 시작 당시의 아미노 전이효소(alanine aminotransferase/aspartic aminotransferase), 알파태아단백(alpha-fetoprotein), 빌리루빈(bilirubin) 수치에 따라 생존율에 차이를 보이는지 하위집단분석을 하였지만, 유의한 결과를 보여주지는 못했다[8].
또한, SHARP 연구에 참여한 환자들의 혈액을 채취하여 생체표지자(biomarker) 연구를 시행하였는데, 혈관내피 성장인자(vascular endothelial growth factor)나 혈관증식인자-2 (angiopoietin2)가 낮은 경우, 치료/대조군에 상관없이 중앙생존기간이 유의하게 길어 예후와 상관관계를 보였고, sorafenib 복용군에서 수용성 c-KIT (soluble c-KIT) 농도가 높거나, 간세포 성장인자(hepatocyte growth factor) 농도가 낮으면 sorafenib 치료로 생존증가효과를 보일 가능성이 높았으나, 통계적으로 유의한 차이는 아니었다[9].
이외에도 sorafenib에 대한 반응을 예측하기 위한 여러 연구가 시행되었지만, 일관된 결과를 보여주지는 못하고 있다.
Sunitinib은 혈관내피 성장인자 수용체 및 혈소판유도 성장인자 수용체 등을 억제하는 다중 키나제 억제제로 신장암(renal cell carcinoma), 위장관 기질종양(gastrointestinal stromal tumor) 및 췌장 내분비 종양(pancreatic neuroendocrine tumor)에서 승인된 약제이다. 최근 sorafenib과 sunitinib을 비교하는 RCT 공개 3상연구의 최종 결과가 발표되었는데, 중앙생존기간이 sunitinib 치료군에서 7.9개월, sorafenib 치료군에서 10.2개월로 우월한 결과를 보여주지 못하고, 부작용도 sunitinib 치료군에서 더 흔하게 발생하여 간세포암종 치료제로서 실패하였다[10].
Erlotinib은 표피 성장인자 수용체 티로신 키나제(epidermal growth factor tyrosine kinase) 억제제로 비소세포성 폐암에서 승인된 약제이다. 최근 720명의 진행성 간세포암종 환자를 대상으로 sorafenib/erlotinib 병합치료군 및 sorafenib/placebo 치료군으로 무작위 배정하는 다기관 3상RCT를 진행하였는데, 중앙생존기간이 sorafenib/erlotinib 병합치료군에서 9.5개월, sorafenib/placebo 치료군에서 8.5개월이었으나, 통계적으로 유의한 차이를 보여주지는 못하였다(상대위험도 0.929, 95% 신뢰구간 0.781-1.106, P=0.204, NCT00901901) [11].
Linifanib은 혈소판유래 성장인자 수용체 및 혈관내피성장인자 수용체에 작용하는 키나제 억제제로, 1,035명의 진행성 간세포암종 환자를 대상으로 3상RCT를 진행하였는데, 중간평가에서 linifanib 복용군에서 부작용이 유의하게 많이 발생하여 연구가 중단되었으며, 연구 중단까지의 중앙생존기간이 linifanib 복용군에서 9.1개월, sorafenib 복용군에서 9.8개월로 유의한 결과를 보여주지 못하였다(NCT01009593) [12].
Brivanib은 혈관내피 성장인자 수용체 및 섬유아세포 성장인자(fibroblast growth factor) 수용체에 대한 선택적 억제제인데, 최근 2개의 3상임상연구 결과가 발표되었다. 1차치료제로서 brivanib과 sorafenib을 비교한 이중맹검 3상RCT를 살펴보면, 무진행 생존기간이나 질병조절률에서는 양군간에 유사한 결과를 보였으나, 중앙생존기간은 brivanib 복용군에서 9.5개월, sorafenib 복용군에서 9.9개월로 연구의 1차 목적에는 부합하지 못하였다[13]. 또한, 다른 2차치료제로서의 brivanib 3상RCT연구에서는 sorafenib으로 일차 치료를 받았으나, sorafenib에 대한 불응성 혹은 불내성을 보인 환자를 대상으로 brivanib 치료군 및 위약대조군에 2:1로 무작위 배정하였다[14]. 무진행 생존기간은 brivanib 치료군에서 4.2개월, 위약대조군에서 2.7개월로 brivanib 치료군에서 유의하게 연장되는 소견을 보였고(상대위험도 0.56, 95% 신뢰구간 0.42-0.76, P<0.001), 질병조절률도 brivanib 치료군에서 61%, 위약대조군에서 40%로 유의하게 높은 결과를 보였으나(P<0.001), 1차 목적이었던 중앙생존기간은 각각 9.4개월과 8.2개월로 brivanib 치료군에서 연장되는 경향을 보였으나, 통계적으로 유의하지는 못하였다(상대위험도 0.89, 95% 신뢰구간 0.69-1.15, P=0.3307) [14]. 이러한 문제는 위약대조군 환자들이 통상적 예측보다 장기 생존하였고 이에 따라 대상환자 수 산출에 문제가 있었던 연구로 보인다.
이와 같이 여러 표적치료제들에 대하여 2상연구 결과들을 바탕으로 3상RCT연구들이 시행되었으나, 현재까지 생존 연장 효과를 보인 약제는 sorafenib 이후에는 없는 실정이다.
Sorafenib이 전신적 항암요법 중 1차치료 약제로 확립되었으나, sorafenib 치료를 하였음에도 불구하고 질병이 진행하는 경우, sorafenib에 대한 부작용 등으로 sorafenib 치료를 지속하기 어려운 경우, 또한, 진행성 간세포암종이지만 보험 급여 적용이 되지 않아(현재 sorafenib의 보험 기준은 stage III 이상, Child-Pugh class A, ECOG 전신 수행 상태 0-2 모두를 만족해야 함) 경제적인 이유로 sorafenib 치료를 하기 어려운 경우 등에 세포독성 화학요법(cytotoxic chemotherapy)을 고려하게 된다. 세포독성 항암요법제들은 대부분 치료반응이 충분하지 않고, 아직까지 RCT 연구를 통해 생존연장효과가 증명된 적은 없다. 그러나 앞의 표적치료제 연구들에서 보았듯이 RCT 연구는 천문학적인 연구비가 필요하기에 수십 년 전에 개발된(그래서 저렴한) 세포독성 항암제의 효과를 sorafenib과 비교하는 3상연구는 현실적으로 어려운 실정이다.
Doxorubicin은 간세포암종에서 가장 많이 연구된 약제 중 하나로 1970년대부터 쓰여왔다[15]. 하지만, doxorubicin 반응률은 대개 20% 미만이며[16,17,18], 아직까지 만족할만한 3상RCT연구가 이뤄지지 않아서 검증된 생존연장효과는 불분명하다. 그러나 nolatrexed 효과 검증을 위한 다기관 3상RCT연구에서 444명의 절제불가능한 간세포암종 환자를 대상으로 nolatrexed의 효과를 doxorubicin을 대조군으로 하여 비교하였는데 1차연구 목적이었던 중앙생존기간은 nolatrexed 치료군에서 에서 22.3주, doxorubicin 치료군에서 32.3주로 오히려 doxorubicin 군에서 유의하게 길었다(상대위험도 0.753, P=0.0068) [19]. 이외에 5-fluorouracil, etoposide, gemcitabine 등도 만족스러운 결과를 보여주지는 못하였다[20,21,22].
단독 약제로서 효과가 미미하기 때문에 복합 항암 요법이 시도되기도 하는데, PIAF (cisplatin, interferon α-2b, doxorubicin, fluorouracil) 요법이 doxorubicin 단독 요법에 비하여 중앙생존기간도 길고(8.67개월 vs. 6.83개월, 상대위험도 0.97, P=0.830), 전체적인 반응률(overall response, 완전관해 혹은 부분관해를 이루는 경우)도 20.9%로 doxorubicin 단독 요법의 10.5%에 비하여 높았으나, 통계적으로 유의한 차이는 아니었다(P=0.058). 또한, 백혈구 감소증이나 혈소판 감소증 등의 부작용은 PIAF 치료군에서 유의하게 많이 발생하였다[23]. 따라서, 부작용을 비교적 잘이겨낼 수 있고, 간기능이 잘 보존되어 있는 경우에서 조심스럽게 시도해볼 수 있겠다.
또 다른 복합 항암 요법 중 하나인 FOLFOX (oxaliplatin, fluorouracil, leucovorin)에 관한 다기관 무작위 배정공개 3상임상시험 결과도 최근에 발표되었는데, 무진행생존기간이나 질병유지율이 모두 FOLFOX 병합치료군에서 doxorubicin 단독치료군에 비하여 유의하게 효과가 좋았지만(2.93개월 v s. 1.77개월, P<0.01; 52.17% v s. 31.55%, P<0.001), 중앙생존기간에 있어서 통계적인 유의성을 보이지는 못하였다(6.4개월 vs. 4.97개월, P=0.07). 부작용 발생에 있어서는 양 군간에 큰 차이를 보이지는 않아[24], 세포독성 화학요법을 시행해야 하는 경우 고려해볼 수 있겠다.
진행성 간세포암종에서 sorafenib이 1차 치료제로서 쓰이고 있으나, 아직 생존 향상의 정도가 기대에 미치지 못하고 있는 것이 현실이다. 따라서, sorafenib 단독요법의 제한적인 효과를 극복하기 위하여 여러 가지 방향의 치료들이 다음과 같이 시도되고 있다.
경동맥 화학색전술(transarterial chemoembolization)은 절제 불가능한 간세포암종에서 가장 많이 행해지는 치료이다. 경동맥 화학색전술과 sorafenib을 병합하여 치료하는 방법에 관하여 많은 연구가 이루어지고 있는데, 50명의 절제 불가능한 간세포암종 환자를 대상으로 경동맥 화학색전술과 sorafenib을 병용치료한 2상 단독군 연구에서 중앙 무진행 생존기간이 7.1개월로 경동맥 화학색전술만 시행한 경우에 비하여 비교적 좋은 효과를 보여 주었다[25]. 또한, 경동맥 화학색전술과 sorafenib을 병용치료한 경우 sorafenib 단독치료와 비교하여 중앙 무진행 생존기간이나 중앙생존기간이 연장되었다는 후향연구결과가 있었으며, 현재이 두 치료법에 대하여 전향적인 3상연구가 진행 중에 있다(NCT01829035) [26].
이외에도 sorafenib과 고주파 열치료술(radiofrequency ablation)을 병합하는 방법(NCT00692770)이나 sorafenib과 방사선치료를 병행하는 방법(NCT01801163, NCT01730937)등이 시도되고 있다.
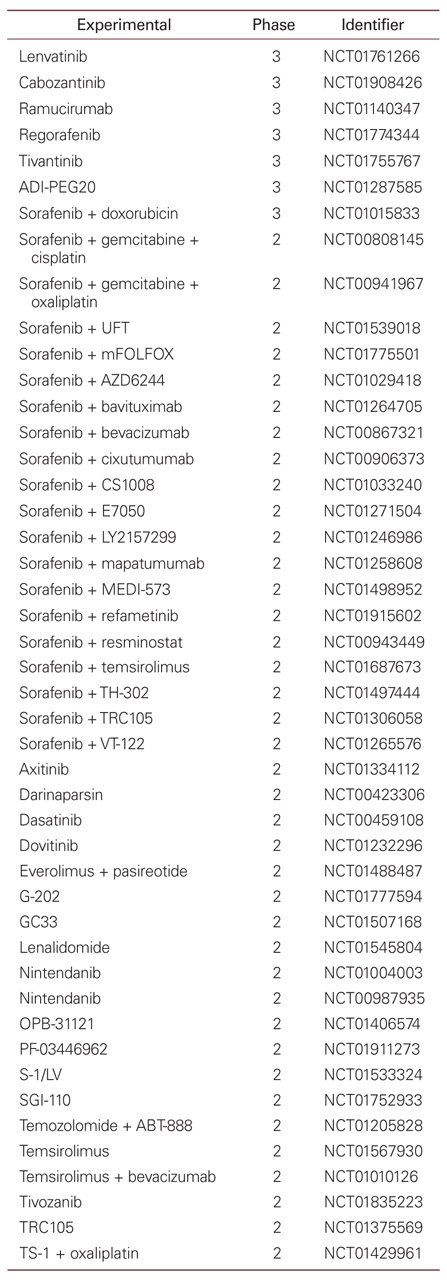
Sorafenib과 doxorubicin 병합요법과 doxorubicin 단독요법을 비교한 2상연구에서 무진행 생존기간 및 중앙 생존기간이 병합요법 군에서 유의하게 연장되는 결과를 보인 바 있다[27]. 하지만, 이 연구는 sorafenib이 1차치료제로서 확립되기 전에 진행된 연구로 대조군이 doxorubicin 단독군이라는 한계가 있으며, 현재 sorafenib과 doxorubicin 병합 요법과 sorafenib 단독요법을 비교하는 3상연구가 진행 중에 있다(NCT01015833). 이외에도 sorafenib과 gemcitabine/cisplatin 병합치료(NCT00808145), sorafenib과 gemcitabine/oxaliplatin 병합치료(NCT00941967), sorafenib과 tegafur/uracil 병합치료(NCT01539018), sorafenib과 oxaliplatin/leucovorin/fluorouracil 병합치료(NCT01775501) 등에 대해서도 2상연구가 진행 중이다. 또한, 세포독성항암제들 이외에도 여러 표적 치료제들과의 병합요법에 관한 연구도 이루어지고있다(Table 2).
Tivantinib은 c-MET 키나제 억제제로 최근 무작위배정, 위약대조 2상연구 결과가 발표되었다. Sorafenib 이후의 2차치료제로 108명의 환자를 대상으로 투약한 결과(2:1배정), 무진행생존기간이 1.6개월로 위약대조군의 1.4개월에 비하여 연장되는 효과를 보였다(상대위험도 0.64, 95% 신뢰구간 0.43-0.94, P=0.04) [28]. 특히, 암조직에서 MET 발현이 높았던 경우 무진행생존기간이 2.7개월로 좀 더 유의한 차이를 보여(상대위험도 0.38, 95% 신뢰구간 0.18-0.81, P=0.01), 현재 MET 발현이 높은 환자를 대상으로 3상임상연구가 진행 중이다(NCT01755767). 이외에도 lenvatinib(혈관내피성장인자 수용체 키나제 억제제, NCT01761266), cabozantinib(c-MET/혈관내피 성장인자 수용체 키나제 억제제, NCT01908426), ramucirumab(혈관내피 성장인자 수용체단일클론항체, NCT01140347), regorafenib(혈관내피 성장인자 수용체 티로신 키나제 억제제, NCT01774344) 등에 대하여 3상임상연구가 진행 중에 있다(Table 2).
Acknowledgement
This study was supported by the National Cancer Center, Korea (grant no. 1110050-1).
References
1. Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, de Oliveira AC, Santoro A, Raoul JL, Forner A, Schwartz M, Porta C, Zeuzem S, Bolondi L, Greten TF, Galle PR, Seitz JF, Borbath I, Haussinger D, Giannaris T, Shan M, Moscovici M, Voliotis D, Bruix J. SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008;359:378-390.


2. Korean Liver Cancer Study Group and National Cancer Center, Korea. Practice guidelines for management of hepatocellular carcinoma 2009. Korean J Hepatol 2009;15:391-423.


3. Wilhelm SM, Adnane L, Newell P, Villanueva A, Llovet JM, Lynch M. Preclinical overview of sorafenib, a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling. Mol Cancer Ther 2008;7:3129-3140.



4. Therasse P, Arbuck SG, Eisenhauer EA, Wanders J, Kaplan RS, Rubinstein L, Verweij J, Van Glabbeke M, van Oosterom AT, Christian MC, Gwyther SG. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. New guidelines to evaluate the response to treatment in solid tumors. J Natl Cancer Inst 2000;92:205-216.


5. Cheng AL, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS, Luo R, Feng J, Ye S, Yang TS, Xu J, Sun Y, Liang H, Liu J, Wang J, Tak WY, Pan H, Burock K, Zou J, Voliotis D, Guan Z. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 2009;10:25-34.


6. Kim BH, Park JW, Lee JH, Koh YH, Kim CM. International Liver Cancer Association. Clinical characteristics of patients with advanced hepatocellular carcinoma showing long-term response to sorafenib International Liver Cancer Association Seventh Annual Conference. 2013 Sep 13-15. Washington, DC, USA: Washington, DC: International Liver Cancer Association. 2013;27.
7. Bruix J, Raoul JL, Sherman M, Mazzaferro V, Bolondi L, Craxi A, Galle PR, Santoro A, Beaugrand M, Sangiovanni A, Porta C, Gerken G, Marrero JA, Nadel A, Shan M, Moscovici M, Voliotis D, Llovet JM. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma: subanalyses of a phase III trial. J Hepatol 2012;57:821-829.


8. Raoul JL, Bruix J, Greten TF, Sherman M, Mazzaferro V, Hilgard P, Scherubl H, Scheulen ME, Germanidis G, Dominguez S, Ricci S, Nadel A, Moscovici M, Voliotis D, Llovet JM. Relationship between baseline hepatic status and outcome, and effect of sorafenib on liver function: SHARP trial subanalyses. J Hepatol 2012;56:1080-1088.


9. Llovet JM, Pena CE, Lathia CD, Shan M, Meinhardt G, Bruix J. SHARP Investigators Study Group. Plasma biomarkers as predictors of outcome in patients with advanced hepatocellular carcinoma. Clin Cancer Res 2012;18:2290-2300.



10. Cheng AL, Kang YK, Lin DY, Park JW, Kudo M, Qin S, Chung HC, Song X, Xu J, Poggi G, Omata M, Pitman Lowenthal S, Lanzalone S, Yang L, Lechuga MJ, Raymond E. Sunitinib versus sorafenib in advanced hepatocellular cancer: results of a randomized phase III trial. J Clin Oncol 2013 Sep 30 [Epub]. DOI: 10.1200/JCO.2012.45.8372.

11. Zhu AX, Rosmorduc O, Evans J, Ross P, Santoro A, Carrilho FJ, Leberre MA, Jensen M, Meinhardt G, Kang YK. European Society for Medical Oncology. SEARCH: a phase III, randomized, double-blind, placebo-controlled trial of sorafenib plus erlotinib in patients with hepatocellular carcinoma (HCC) Proceedings of the 37th European Society for Medical Oncology Congress. 2012 Sep 28-Oct 2. Vienna, Austria: London: Oxford University Press. 2012;917.
12. Cainap C, Qin S, Huang WT, Chung IJ, Pan H, Cheng Y, Kudo M, Kang YK, Chen PJ, Toh HC, Gorbunova V, Eskens F, Qian J, McKee MD, Ricker JL, Carlson DM, Nowien SE. Phase III trial of linifanib versus sorafenib in patients with advanced hepatocellular carcinoma (HCC). J Clin Oncol 2013;31:249.

13. Johnson PJ, Qin S, Park JW, Poon RT, Raoul JL, Philip PA, Hsu CH, Hu TH, Heo J, Xu J, Lu L, Chao Y, Boucher E, Han KH, Paik SW, Robles-Avina J, Kudo M, Yan L, Sobhonslidsuk A, Komov D, Decaens T, Tak WY, Jeng LB, Liu D, Ezzeddine R, Walters I, Cheng AL. Brivanib versus sorafenib as first-line therapy in patients with unresectable, advanced hepatocellular carcinoma: results from the randomized phase III BRISKFL Study. J Clin Oncol 2013;31:3517-3524.


14. Llovet JM, Decaens T, Raoul JL, Boucher E, Kudo M, Chang C, Kang YK, Assenat E, Lim HY, Boige V, Mathurin P, Fartoux L, Lin DY, Bruix J, Poon RT, Sherman M, Blanc JF, Finn RS, Tak WY, Chao Y, Ezzeddine R, Liu D, Walters I, Park JW. Brivanib in patients with advanced hepatocellular carcinoma who were intolerant to sorafenib or for whom sorafenib failed: results from the randomized phase III BRISK-PS Study. J Clin Oncol 2013;31:3509-3516.


15. Olweny CL, Toya T, Katongole-Mbidde E, Mugerwa J, Kyalwazi SK, Cohen H. Treatment of hepatocellular carcinoma with Adriamycin: preliminary communication. Cancer 1975;36:1250-1257.


16. Chlebowski RT, Brzechwa-Adjukiewicz A, Cowden A, Block JB, Tong M, Chan KK. Doxorubicin (75 mg/m2) for hepatocellular carcinoma: clinical and pharmacokinetic results. Cancer Treat Rep 1984;68:487-491.

17. Choi TK, Lee NW, Wong J. Chemotherapy for advanced hepatocellular carcinoma: adriamycin versus quadruple chemotherapy. Cancer 1984;53:401-405.


18. Sciarrino E, Simonetti RG, Le Moli S, Pagliaro L. Adriamycin treatment for hepatocellular carcinoma: experience with 109 patients. Cancer 1985;56:2751-2755.


19. Gish RG, Porta C, Lazar L, Ruff P, Feld R, Croitoru A, Feun L, Jeziorski K, Leighton J, Gallo J, Kennealey GT. Phase III randomized controlled trial comparing the survival of patients with unresectable hepatocellular carcinoma treated with nolatrexed or doxorubicin. J Clin Oncol 2007;25:3069-3075.


20. Tetef M, Doroshow J, Akman S, Coluzzi P, Leong L, Margolin K, Morgan RJ Jr, Raschko J, Shibata S, Somlo G. 5-Fluo-rouracil and high-dose calcium leucovorin for hepatocellular carcinoma: a phase II trial. Cancer Invest 1995;13:460-463.


21. Melia WM, Johnson PJ, Williams R. Induction of remission in hepatocellular carcinoma: a comparison of VP 16 with adriamycin. Cancer 1983;51:206-210.


22. Yang TS, Lin YC, Chen JS, Wang HM, Wang CH. Phase II study of gemcitabine in patients with advanced hepatocellular carcinoma. Cancer 2000;89:750-756.


23. Yeo W, Mok TS, Zee B, Leung TW, Lai PB, Lau WY, Koh J, Mo FK, Yu SC, Chan AT, Hui P, Ma B, Lam KC, Ho WM, Wong HT, Tang A, Johnson PJ. A randomized phase III study of doxorubicin versus cisplatin/interferon alpha-2b/doxorubicin/fluorouracil (PIAF) combination chemotherapy for unresectable hepatocellular carcinoma. J Natl Cancer Inst 2005;97:1532-1538.

24. Qin S, Bai Y, Lim HY, Thongprasert S, Chao Y, Fan J, Yang TS, Bhudhisawasdi V, Kang WK, Zhou Y, Lee JH, Sun Y. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus Doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia. J Clin Oncol 2013;31:3501-3508.


25. Park JW, Koh YH, Kim HB, Kim HY, An S, Choi JI, Woo SM, Nam BH. Phase II study of concurrent transarterial chemoembolization and sorafenib in patients with unresectable hepatocellular carcinoma. J Hepatol 2012;56:1336-1342.


26. Park JW, Kim YJ, Kim DY, Choi JY, Yeon JE, Han SY, Cheong JY, Kwon OS, Kim HY, Lee HC, Lee KS, Kim BH, Paik SW. International Liver Cancer Association. A randomized, controlled phase III trial of sorafenib with or without conventional transarterial chemoembolization in patients with advanced hepatocellular carcinoma (STAH) International Liver Cancer Association Seventh Annual Conference. 2013 Sep 13-15. Washington, DC, USA: Washington, DC: International Liver Cancer Association. 2013;69.
27. Abou-Alfa GK, Johnson P, Knox JJ, Capanu M, Davidenko I, Lacava J, Leung T, Gansukh B, Saltz LB. Doxorubicin plus sorafenib vs doxorubicin alone in patients with advanced hepatocellular carcinoma: a randomized trial. JAMA 2010;304:2154-2160.


28. Santoro A, Rimassa L, Borbath I, Daniele B, Salvagni S, Van Laethem JL, Van Vlierberghe H, Trojan J, Kolligs FT, Weiss A, Miles S, Gasbarrini A, Lencioni M, Cicalese L, Sherman M, Gridelli C, Buggisch P, Gerken G, Schmid RM, Boni C, Personeni N, Hassoun Z, Abbadessa G, Schwartz B, Von Roemeling R, Lamar ME, Chen Y, Porta C. Tivantinib for second-line treatment of advanced hepatocellular carcinoma: a randomised, placebo-controlled phase 2 study. Lancet Oncol 2013;14:55-63.


29. ClinicalTrials.gov [Internet] Bethesda: US National Institutes of Health. 2013;cited 2013 Nov 4. Available from: http://clinicaltrials.gov
- TOOLS
-
METRICS

-
Related articles in
J Korean Med Assoc -
Current advances in pharmacotherapy for schizophrenia2024 February;67(2)
Recent advances in the treatment of multiple myeloma2023 April;66(4)
Early Hepatocellular Carcinoma2000 June;43(6)
Radiofrequency Thermal Ablation of Hepatocellular Carcinoma2001 August;44(8)
Recent Advances in Musculoskeletal Nuclear Medicine2003 March;46(3)