자가면역 관련 사이질폐질환 치료의 최신지견
Current advances in the treatment of autoimmune-associated interstitial lung diseases
Article information
Trans Abstract
Autoimmune-associated interstitial lung disease (ILD) is a widespread and clinically significant form of autoimmune diseases. ILD can be present in most type of autoimmune diseases. Scleroderma, Sjogren syndrome, rheumatoid arthritis, inflammatory myositis, systemic lupus erythematosus, and mixed connective tissue disease are all examples of autoimmune disorders that can cause ILD. Treatment and prognosis vary from that of other forms of ILD depending on the etiology and pathogenesis of the autoimmune disease. As a result, glucocorticoids and immunosuppressive agents are the mainstays of treatment for autoimmune-associated ILD, despite the fact that there is little high-level evidence to guide the treatment owing to limited data from randomized controlled trials. Immunosuppressive agents including cyclophosphamide, tacrolimus, azathioprine, and mycophenolate mofetil can be used to reduce the dose of glucocorticoids and the inflammatory cascade and inhibit various pro-inflammatory cytokines. Studies have also started alternative therapeutic approaches, such as biological and antifibrotic agents, and traditional immunosuppressive agents. In this review, we summarize available treatment options and recent advances in therapeutic strategies for patients with autoimmune-associated ILD.
서론
자가면역 관련 사이질폐질환은 다양한 사이질폐질환의 분류 중에서 자가항체에 의한 과도한 면역반응이 폐손상을 유발하여 폐가 섬유화되는 사이질폐질환이다[1]. 자가면역질환의 이상반응은 기도, 흉막, 흉곽 및 폐혈관 등 폐 전체를 침범할 수 있으며, 이중에서 사이질을 주로 침범한 경우가 가장 흔하고, 국내 지침에서는 결체조직 관련 사이질폐질환(connective tissue-associated interstitial lung disease, CTD-ILD)으로 분류하였다[2]. 자가면역질환 이외의 다른 원인에 의한 사이질폐질환과 명확한 원인이 밝혀지지 않은 특발성사이질폐질환과 비교해서, 세포면역과 체액면역을 모두 포함한 자가면역의 이상반응이 초기의 폐 손상을 유발하고 폐의 섬유화에 기여하는 것으로 알려져 있다[3]. 이러한 병태생리에 의해서 자가면역 관련 사이질폐질환에서는 자가면역을 억제하는 역할을 하는 스테로이드와 면역억제제가 주로 사용되고, 이러한 약제는 특발성폐섬유증 환자에게는 오히려 해가 될 수 있기 때문에 정확한 진단과 치료가 중요하다[4]. 사이질폐질환은 국내외 지침에서 호흡기내과, 영상의학과 및 병리과 의사가 참여한 다학제적 토의를 통해 진단할 것을 권고하고 있으며, 특히 최근에는 자가면역질환의 감별진단을 위해 류마티스내과 의사의 참여를 강조하였다[2,5]. 자가면역 관련 사이질폐질환은 기존에 자가면역질환으로 진단된 환자에서 발생할 수도 있지만, 사이질폐질환이 자가면역질환의 첫 증상으로 사이질폐질환 발생 이후에 자가면역질환이 진단되는 경우도 있기 때문에 사이질폐질환 환자뿐만 아니라 자가면역질환 환자에서 모두 자가면역 관련 사이질폐질환의 동반을 확인하려는 노력이 필요하다. 자가면역 관련 사이질폐질환은 보고에 따라 다양하지만, 전체 사이질폐질환의 약 20%를 차지하며 대표적인 특발성사이질폐질환인 특발성폐섬유증에 비해서는 예후가 양호한 것으로 알려져 있다[6]. 본문에서는 자가면역 관련 사이질폐질환 치료의 최신지견 및 현재 국내에서 가능한 치료에 대해 이야기하고자 한다.
치료의 중요성
자가면역질환 환자에서 사이질폐질환의 동반은 삶의 질과 예후에 중대한 영향을 미친다. 사이질폐질환 동반의 빈도가 가장 높은 전신경화증(systemic sclerosis) 환자에서 사이질폐질환이 동반된 경우 사망률이 유의하게 높았고 폐 침범이 주요 사망원인이었다[7,8]. 원발성 쇠그렌증후군(primary Sjögren syndrome) 환자를 대상으로 한 코호트 연구에서, 사이질폐질환이 동반된 군에서 사이질폐질환이 없는 군과 비교해서 네 배 정도 높은 사망률을 보였다[9]. 류마티스관절염 환자를 대상으로 한 연구에서는 약 10%의 환자에서 사이질폐질환이 동반되었고, 사이질폐질환이 동반되지 않은 류마티스관절염 환자에 비해 성별에 상관없이 사망에 이르는 나이가 적었고 사망률이 유의하게 높았다[10]. 이처럼 자가면역질환 환자에서 사이질폐질환의 동반은 나쁜 예후와 연관되어 있기 때문에 자가면역 관련 사이질폐질환을 조기에 진단하고 적극적으로 치료하는 것은 매우 중요하다. 하지만 자가면역 관련 사이질폐질환은 유병률이 낮고 전신경화증에서의 소수의 연구들을 제외하고는 대 규모의 무작위대조군연구가 없기 때문에, 제한된 연구결과를 바탕으로 한 경험적인 치료를 할 수밖에 없다는 현실적인 어려움이 있다.
치료의 결정
다른 사이질폐질환과 마찬가지로 모든 자가면역 관련 사이질폐질환 환자에게 치료가 필요하지는 않다. 자가면역 관련 사이질폐질환의 중증도 평가 및 치료 시작 시점에 대한 연구가 부족하고 개인 또는 자가면역질환에 따라 병의 경과가 다양하기 때문에, 치료의 결정을 위해서는 특발성폐섬유증 환자와 전신경화증 환자에서 활용되는 중증도 기준과 환자의 주관적인 증상 및 병의 진행여부를 종합적으로 고려해서 치료 여부를 결정해야 한다[11]. 진단 당시 병의 중증도를 평가하기 위해서, 특발성폐섬유증에서 사용되는 ILD-GAP index (gender, age, physiology)를 활용할 수 있고, 전신경화증 환자에서는 고해상도컴퓨터단층촬영(high resolution computed tomography, HRCT)에서 섬유화 정도(전체 폐면적의 20% 기준)와 폐기능검사에서 강제폐활량(forced vital capacity [FVC] 70% 기준)을 활용하여 구분하는 방법을 활용해 볼 수 있다[12-14]. 또한 질병의 진행으로 정의되는 유의한 폐기능의 감소(FVC >10% 또는 이산화탄소 폐확산능(diffusing capacity for carbon monoxide [DLco] >15%)와 6분 보행검사에서 불포화화 또는 보행거리의 감소를 고려하여 병의 진행여부를 판단하고 치료의 시작을 결정해야 한다[15,16]. 또한 치료과정에서 면역억제제의 부작용 및 면역기능저하로 발생할 수 있는 기회감염성 질환에 대한 세심한 주의가 필요하다. 치료의 목표는 자가면역 관련 사이질폐질환의 질병 활성도를 안정시키고 병의 진행을 억제하는 것이며, 환자의 폐 이외의 자가면역질환의 증상과 그 정도에 따라 임상(호흡기내과 및 류마티스내과)에서 협의를 통해 적절한 약제의 선택과 조절이 필요하다. 최근 호주와 뉴질랜드 흉부학회에서는 CTD-ILD의 진단과 치료에 대한 알고리즘을 제시하였다(Figure 1) [11].
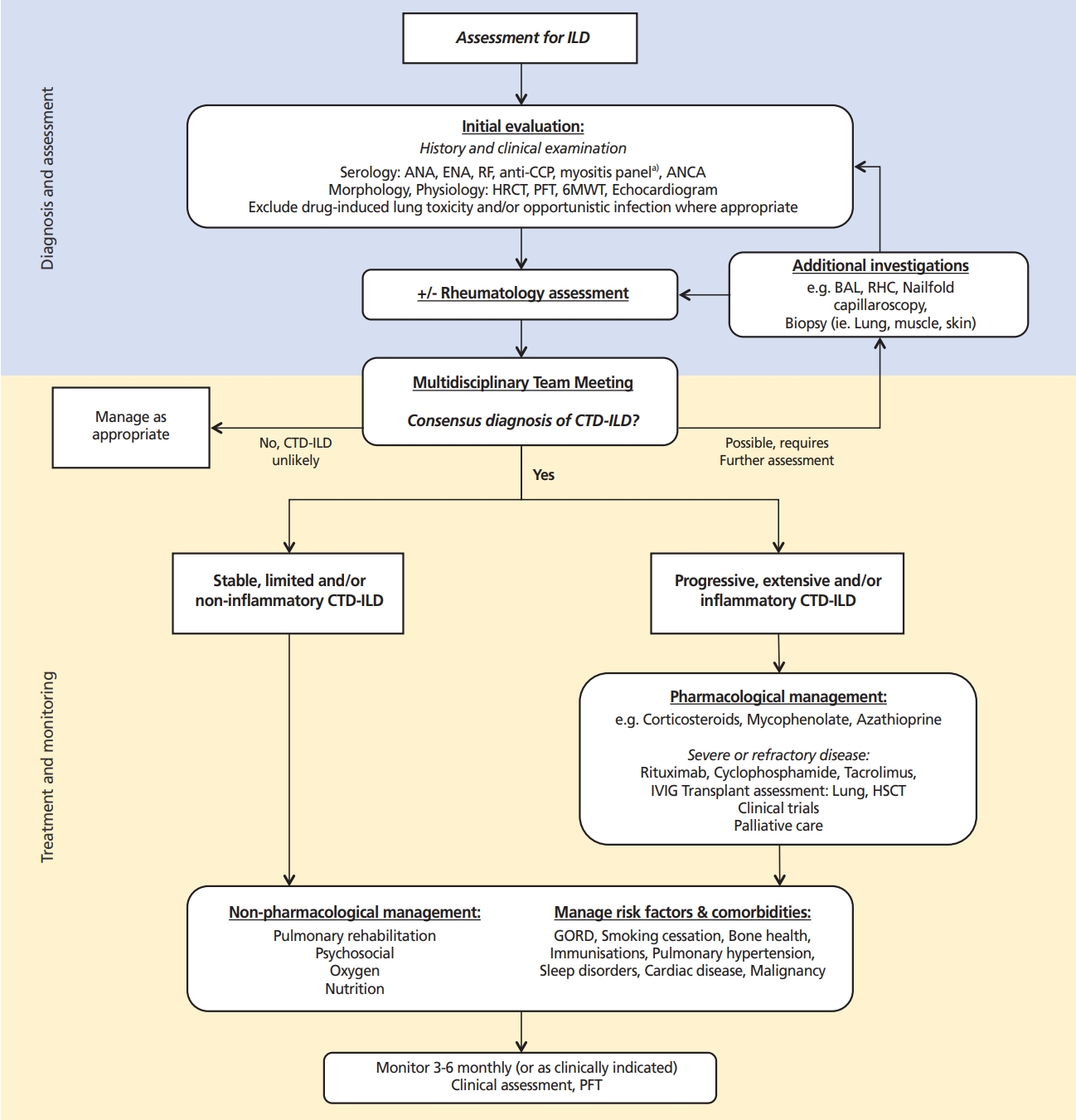
Suggested algorithm for the diagnosis and management of connective tissue disease-associated interstitial lung disease (CTD-ILD) in the Thoracic Society of Australia and New Zealand. Adapted from Jee AS et al. Respirology 2021;26:23-51, according to the Creative Commons license [11]. ILD, interstitial lung disease; ANA, antinuclear antibody; ENA, extractable nuclear antigen; RF, rheumatoid factor; CCP, cyclic citrullinated peptide; ANCA, anti-neutrophil cytoplasmic antibody test; HRCT, high resolution computed tomography; PFT, pulmonary fuction test; 6MWT, 6-minute walk test; BAL, bronchoalveolar lavage; RHC, right heart catheterization; IVIG, intravenous immunoglobulin; HSCT, hematopoietic stem cell transplantation; GORD, gastro-oesophageal reflux disease.
치료약제의 선택
치료의 근간이 되는 스테로이드 중에서 가장 많이 사용되는 약제는 부신피질에서 생성되는 글루코코티코이드(glucocorticoid)이다. 글루코코티코이드는 선천면역 및 후천면역에 모두 작용하고, 다양한 염증세포 및 염증성 사이토카인의 생성과 분비를 억제하여 면역조절 및 항염증 작용을 한다. 확립된 용량, 기간 및 감량에 대한 기준은 없어서, 임상의의 경험과 환자의 상태 변화 및 치료에 대한 반응을 토대로 사용해야 한다. 통상적으로 초기 고용량(0.5-1 mg/kg)으로 시작하여, 환자의 임상경과 및 치료반응에 따라 감량하여 유지요법(10-20 mg)으로 사용되며, 전신경화증의 경우 신장위기의 위험이 있어, 주의가 필요하다[11]. 장기간 글루코코티코이드를 사용할 때는, 기회감염, 골다공증, 위장장애, 부종 등의 부작용에 대한 주의가 필요하며, 1일 15-20 mg 이상의 용량을 30일 이상 사용할 경우 사람폐포자충 감염을 예방하기 위한 예방적 항생제의 사용이 추천된다[11,17].
Mycophenolate mofetil (MMF)는 세포가 분열하는데 필수적인 데옥시리보핵산(deoxyribonucleic acid) 합성과정에서 사용되는 퓨린(purine)의 합성을 억제해서, 림프구(lymphocyte)의 분열을 억제하는 대사억제제이다. 최근의 연구들에서 전신경화증을 포함한 다양한 자가면역 관련 사이질폐질환 환자에서 장기간의 사용에도 비교적 안전하여 부작용이 적고 폐기능의 안정화에 대한 유의한 효과를 보여주어 사용이 선호되고 있다[18-20]. 국내에서도 개정된 급여기준에 따르면, MMF는 사이질폐질환이 동반된 전신경화증에서, 한 종 이상의 다른 면역억제제의 사용에도, 불충분한 반응을 보이면서 강제폐활량이 45-80%인 경우에는 보험급여로 사용이 가능하게 되었다.
아자싸이오프린(azathioprine, AZA)은 림프구의 활성을 억제하는 대사억제제 중의 하나로 주로 스테로이드와 병합하여 사용된다. 특발성 비특이사이질폐렴 및 사코이드증(sarcoidosis)에서 사용되며, 최근 소규모의 후향적 연구에서 전신경화증 및 원발성 염증근육병증 등이 포함된 자가면역 관련 사이질폐질환 환자에서 폐기능을 안정화 시켜주는 효과가 보고 되었지만 아직 근거는 부족하다[21]. 이전의 소규모 전향적 무작위대조군연구에서 사이클로포스퍼마이드(cyclophosphamide, CYC) 정주(6개월) 이후에 AZA의 유지요법이 위약군과 비교해서 통계적으로 유의하지는 않았지만, 1년 후의 폐기능(FVC)을 안정화시키는 결과가 보고되었다[22]. 하지만 CYC와 AZA 두 약제의 폐기능 보존효과를 직접 비교했던 연구에서는 AZA군에서 CYC군과 비교해서 폐기능의 악화가 보고되었다[23]. 단독사용보다는 스테로이드와 병합하여 스테로이드 용량을 줄여주는 목적 또는 유지요법의 대체약제로 사용을 고려할 수 있다.
CYC는 데옥시리보핵산에 직접 결합하여 림프구에 세포독성을 보여 세포 및 체액면역을 억제하는 알킬화제(alkylating agent)이다. Scleroderma Lung Study (SLS) Ⅰ 연구에서 12개월간 경구용법(2 mg/kg/day)은 위약군과 비교해서 FVC 감소를 줄여주고 증상 및 삶의 질을 호전시키는 유의한 효과가 입증되었다. 하지만 폐기능 보존효과는 치료 종료 12개월 후에는 유지되지 않았다. 약제에 의한 부작용으로 출혈방광염, 백혈구감소 및 빈혈 등의 발생이 비교적 흔한 것으로 알려져 있고, 장기간 사용 시에는 암 발생의 위험도가 있어 사용에 주의가 필요하다[24]. 6개월 이상 장기간의 사용이 필요할 경우 MMF 또는 AZA로 바꾸어 유지요법을 고려할 수 있다[25].
타크로리무스(tacrolimus)와 사이클로스포린(cyclosporine)은 칼시뉴린(calcineurin) 경로를 억제하여, T림프구 활성화 및 인터루킨(interleukin)-2 생성 과정을 억제하는 칼시뉴린 억제제이다. 특히 원발성 염증근육병증 환자에서 스테로이드에 반응이 없는 경우, CD8 T세포가 증가되어 있다는 연구결과를 바탕으로, 염증근육병증 환자를 대상으로 주로 연구가 이루어졌다[26]. 원발성 염증근육병증 환자를 대상으로 시행된 후향적 연구에서 스테로이드와 같이 사용하여, 폐기능 보존 및 생존율을 증가시킨다는 결과들이 보고되었지만 추가적인 전향적 연구가 필요하다[27-29]. 타크로리무스는 일본에서 많이 사용되는 약제로 사이클로스포린에 비에 약물효능이 크고 안정적으로 혈액 내 약물농도가 유지된다는 보고들이 있다[30-32]. 불응성 염증근육병증 환자를 대상으로 한 체계적 문헌고찰에서 타크로리무스의 사용은 글루코코티코이드의 사용 용량을 줄여주고 폐기능의 개선 또는 보존효과가 있음이 보고되었다[33].
리툭시맙(rituximab)은 성숙한 B림프구의 표면에서만 선택적으로 발현되는 단백질인 CD20에 대한 단클론항체(monoclonal antibody)로 항체 의존 세포독성 및 보체 의존 세포독성을 통해 B림프구를 고갈시키는 약물이다. 전신경화증 환자를 대상으로 한 소규모의 무작위대조군연구에서 대조군(CYC)과 비교해서 리툭시맙군(1 g, 2주 간격 2회)에서 6개월 간의 짧은 기간이지만 폐기능(FVC)의 보존효과와 상대적으로 작은 약제 부작용을 보여주었다[34]. 류마티스관절염관련 사이질폐질환(rheumatoid arthritis-associated interstitial lung disease, RA-ILD) 환자를 대상으로 한 후향적 관찰연구에서 폐기능(FVC, DLco)을 보존시켜주는 효과와 CYC보다 작은 약제의 부작용이 보고되었다[35,36]. 기존의 면역억제제 치료에 반응하지 않고 진행하는 중증의 난치성 CTD-ILD 환자를 대상으로 한 소규모 후향적 연구에서 투여 전과 비교해서 투여 후 6-12개월 동안 폐기능을 안정시키는 효과가 보고되었다[37]. 추가적인 연구가 필요하지만 기존 면역억제제에 반응이 없고 진행하는 자가면역 관련 사이질폐질환 환자에게 제한적으로 리툭시맙을 고려해 볼 수 있다[38].
항섬유화제(anti-fibrotic agents)는 특발성폐섬유증의 무작위배정 위약대조군연구에서 1년 동안 FVC의 감소를 50%정도 늦춰주고 급성악화도 감소시키는 효과가 입증되어 특발성폐섬유증의 치료제로 널리 사용되고 있다[39,40]. 특발성폐섬유증 이외의 다른 사이질폐질환이 특발성폐섬유증의 경과와 유사하게 섬유화가 진행되고 폐기능이 악화되는 경우 진행성섬유화 사이질폐질환(progressive fibrosing-interstitial lung disease)이라는 표현형으로 분류되고 있다. 이런 경우 특히 폐기능의 저하는 사망률의 증가와 연관이 있다는 연구결과들이 발표되면서, 사이질폐질환의 원인에 따른 치료 접근 이외에도 섬유화의 진행이라는 표현형에 따른 치료에 대한 관심이 증가하고 있다[15,41]. 원인 및 초기 작용기전은 다를 수 있지만, 섬유모세포와 근섬유모세포에 의한 세포외기질 침착이라는 공통 최종 경로가 병의 경과에 중요하다는 이론을 토대로 한 치료적 접근방식이다. 그 중에서도 섬유아세포, 혈관내피, 헐소판유래성장인자를 동시에 억제하여 작용하는, 타이로신인산화효소(tyrosine kinase) 수용체 차단제로, 특발성폐섬유증 환자에서 폐기능의 감소를 늦추는 효과가 증명된 닌테다닙(nintedanib)은 특발성폐섬 유증 이외의 다른 진행성 섬유화 사이질폐질환 및 전신경화증관련 사이질폐질환 환자에서도 효과가 있음을 증명하고자 하는 연구가 최근에 진행되었다[41-43]. 진행성섬유화 사이질폐질환 환자를 대상으로 한 INBUILD 연구에서는 자가면역 관련 사이질폐질환 환자가 24.7% 포함되었고(류마티스관절염 12.7%, 전신경화증 6.9%, 혼합결합조직병 2.1%), 진행성섬유화 사이질폐질환 환자 및 하위집단 분석에서 자가면역 관련 사이질폐질환 환자에서도 닌테다닙이 연간 FVC 감소속도를 유의하게 줄여주는 효과가 있음이 보고되었다[42]. 전신경화증 환자를 대상으로 했던 SENSCIS 연구에서 위약군에 비교해서 닌테다닙을 복용했던 환자군에서 연간 FVC의 감소 속도를 44% 정도 늦춰주는 유의한 효과가 보고되었다[43]. 이러한 연구결과들을 바탕으로 국내에서도 진행성 섬유화 표현형을 나타내는 만성섬유성 사이질폐질환 환자에서 닌테다닙이 식품의약품안전처에서 사용허가 되었다. 하지만 닌테다닙은 국내에서 급여 적용이 되지 않아 비용 측면에서 현실적으로 사용하기에 어려움이 있고, 현재 국내에서 보험급여가 적용되고 있는 피르페니돈(pirfenidone)의 경우 자가면역 관련 사이질폐질환 환자에 대한 근거는 아직 부족하다. 향후에 SLS Ⅲ 연구를 포함한 진행 중인 연구결과에 따라 피르페니돈의 효과가 입증되어 국내에서 허가 후 사용될 수 있기를 기대한다. 치료제로 사용할 수 있는 약제의 기전, 대상질환, 용법을 Table 1에 정리하였다[11,18,20-23,30,32,35,36,42-55].
치료의 최신지견
전신경화증은 비록 동양인에서는 유병률이 낮지만 북미와 유럽에서는 CTD-ILD의 중요한 원인이다. 전신경화증에서는 CYC와 MMF의 효과에 대한 임상시험이 진행되었고, 그 결과는 전신경화증뿐만 아니라 다른 CTD-ILD에서도 면역억제제를 사용하는 근거가 되고 있다(Table 2) [20,22,44]. 최근에 인터루킨6 수용체에 대한 단클론항체 치료제인 tocilizumab의 3상 연구결과가 발표되었다[45]. focuSSced 연구는 발병 5년 이하이고, 피부 두께 정도를 평가하는 로드난 피부 점수(modified Rodnan Skin Score, mRSS) 10-35점 사이의 진행 가능성이 큰 미만성 전신경화증 환자군을 대상으로 위약대비 tocilizumab 162 mg, 1주 간격 피하주사의 효과를 평가한 임상시험으로 동양인은 일본인이 포함되었다. 일차결과지표인 mRSS의 유의미한 차이는 없었지만, 이차결과지표 중의 하나인 FVC의 48주째 감소는 tocilizumab 군에서 유의미하게 낮았으며(위약군과 차이 4.2%; 95% 신뢰구간, 2.0-6.4), FVC 감소가 10% 이상인 환자의 비율도 더 낮았다(5% 대 17%). 연구의 일차결과지표가 유의미하지 않을 경우 유의미한 이차결과지표는 회의적으로 보는 것이 일반적이다. 하지만 전신경화증이 혈관병리, 면역이상, 섬유화 등 다면적인 병태생리를 가지는 다기관 질환이라는 점과 임상연구 결과 변수로 mRSS의 한계를 감안하여야 하며, 미국류마티스학회의 ACR-CRISS (American College of Rheumatology Composite Response Index in Systemic Sclerosis)와 같은 복합지표를 이용하여 focuSSced 연구를 포함한 임상시험 결과를 해석할 경우 유의미한 결과를 보인다는 보고도 있어, 전신경화증 환자에 대한 tocilizumab의 폐기능 보존에 대한 효과에 의미를 부여할 수 있다[56]. focuSSced 연구대상 환자는 사이질폐질환이 없는 환자도 포함하여 진행되었기 때문에, SRS-I, SRS-II 및 SENSCIS 연구대상 환자들보다 기저 폐기능이 좋았으며(평균 FVC 82%, HRCT에서 폐섬유 정도 2-17%), 따라서 이 연구결과는 비교적 초기 전신경화증 사이질폐질환 환자에서도 적용되는 것으로 해석할 수 있다. focuSSced 연구결과는 기존에 사용되던 면역억제제에 추가로 새로운 생물학적제제를 이용한 효과적인 치료전략에 대한 필요성을 조명하는 연구로 평가된다.
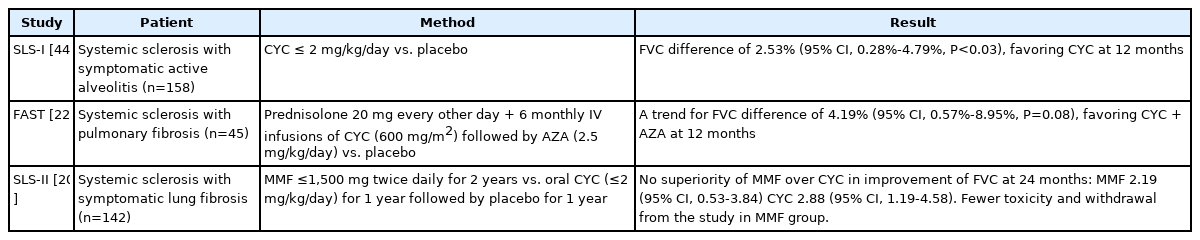
Summary of randomized controlled clinical trials of immunosuppressive therapy in systemic sclerosis-associated interstitial lung disease
RA-ILD와 관련하여 최근 연구결과들은 메토트렉세이트(methotrexate, MTX)의 폐에 대한 영향을 재조명하였다. MTX는 류마티스관절염 치료의 중심일 뿐만 아니라 관찰연구를 통하여 사망률의 감소효과까지 있음이 알려진 중요한 약제이다[57,58]. 하지만 MTX는 급성 사이질폐렴(MTX-associated interstitial pneumonitis, MTX-pneumonitis)을 포함한 폐독성을 유발할 수 있음이 알려져 있고, 초창기 단면연구들은 MTX가 만성 폐섬유증을 유발한다는 상관관계를 보고하였다[59]. MTX에 의한 RA-ILD 발병과 진행의 가속화에 대한 염려로, RA-ILD 환자에서 MTX 처방을 피하거나 중단하는 경향의 근거가 되었다. 하지만 MTX의 RA-ILD에 대한 영향은 일종의 과민반응인 MTX-pneumonitis와 RA-ILD를 구분하지 못하고 초기의 연구에서 조기에 RA-ILD를 적절히 진단하지 못했기 때문에 과장된 것이라는 반론도 있었다.
Cardiovascular inflammation Reduction Trial (CIRT)은 기저 심혈관질환과 당뇨 또는 대사증후군이 있는 심혈관질환의 고위험군 성인에서 류마티스질환의 치료에 사용되는 것과 같은 저용량 MTX의 심혈관질환 예방효과를 증명하기 위한 임상연구이다[60]. CIRT는 심혈관질환의 예방효과를 증명하지 못하고 조기 종료되었지만, 이 연구의 안전성 데이터는 폐독성을 포함한 MTX의 안정성에 대한 중요한 파생 연구결과들의 근거가 되었다. 폐독성만을 분석한 연구에 의하면 심각한 폐부작용은 발생빈도가 매우 낮았고(MTX군에서 0.5%, 위약군에서 0.3%), 잠재적 폐렴증의 발생률은 각각 0.3%와 0.1% 미만이었다. 이 연구에서 여성, 백인, 인슐린의 사용이 폐부작용 발생과 관련된 위험인자였다[61].
최근에 발표된 류마티스관절염 환자를 대상으로 한 관찰연구들은 MTX가 RA-ILD와 상관관계가 없거나 반대의 상관관계에 있음을 보여주었다. 덴마크의 행정등록시스템 데이터를 이용한 연구는 기저 폐질환이 없는 류마티스관절염 환자 30,512명에서 MTX 선행 노출과 폐질환 발생 및 호흡부전과의 상관관계를 분석하였다[62]. MTX는 1년과 5년 후 RA-ILD 발생과 상관관계가 없었으며 통계적으로 유의하게 낮은 호흡부전과 상관관계가 있었다(1년 위험률 0.48; 95% 신뢰구간, 0.32-0.73; 5년 위험률 0.54; 95% 신뢰구간, 0.43-0.67). MTX 투약력이 있는 환자는 일반 인구에 비해 사이질폐질환의 발생률이 약 3-4배 높았지만(standardized incidence ratio 3.6; 95% 신뢰구간, 2.9-4.3), 폐독성이 거의 없는 것으로 알려진 설파살라진(sulfasalazine) 투여 환자에서의 발생률과 차이가 없어, 류마티스관절염 환자에서 사이질폐질환의 발생이 증가하지만 MTX 사용과는 인과관계가 없음을 시사하였다. 프랑스 RA-ILD 네트워크의 자료를 이용해서 유럽과 아메리카 인구에서 검증을 거친 연구는 RA-ILD 선별검사로 HRCT를 시행하였으며, 선행하는 MTX노출과 RA-ILD 발생과의 상관관계를 후향적으로 분석하였다[63]. MTX를 이전에 사용했던 군에서 대조군과 비교해서 RA-ILD의 발생이 유의하게 작았고(교차비 0.44; 95% 신뢰구간, 0.24-0.81) RA-ILD 발생까지의 시간이 통계적으로 유의하게 길었다(11.4년 대 4년). 상기 두 관찰연구 결과들은 대규모 인구를 대상으로 한 점, 기저 사이질폐질환 가능성을 HRCT로 배제한 점 등 장점이 있지만, 근본적으로 적응에 의한 교란의 가능성을 배제할 수 없다는 제한점이 있다. 하지만 윤리적인 문제 등으로 위약대조 임상시험이 진행되기 어려운 점 등을 감안하면 최근의 MTX와 RA-ILD에 대한 관찰연구 결과들은 CIRT 연구결과와 함께 MTX의 폐부작용의 위험은 이전에 우려했던 것보다 크지 않으며, 잠재적으로 RA-ILD 발생과 진행을 억제할 가능성이 있음을 시사한다[64]. 주의해야 할 점은 기저 RA-ILD는 MTX-pneumonitis의 위험인자임을 시사하는 연구결과가 있고, MTX-pneumonitis의 병력이 있는 환자에서 MTX의 재투여는 치명적인 결과를 가져올 수 있는 것으로 보고되어, 기저 RA-ILD가 있거나 MTX-pneumonitis의 병력이 있는 환자에서 MTX의 투여는 주의가 필요하다[65-67].
염증근육병증과 관련된 사이질폐질환에서는 빠르게 진행하는 사이질폐질환(rapidly progressive ILD, RP-ILD)과 관련되어 불량한 예후인자로 알려져 있는 anti-melanoma differentiation-associated gene-5 antibody 양성 피부근육염(anti-MDA-5-positive DM)에서 면역조절 치료의 효과에 대한 연구결과들이 보고되었다. Anti-MDA-5-positive DM은 6개월 사망률이 약 50%에 이르고 폐질환 외에 피부 및 근육병증이 없는 경우도 있어 진단과 치료에 많은 어려움이 있다[68]. Anti-MDA-5 antibody가 처음 발견되고 정립된 일본에서 많은 연구가 진행되고 있는데, 29명의 anti-MDA-5-positive DM 환자를 대상으로 CYC, 타크로리무스와 글루코코티코이드 병합치료와 기존의 고식적인 단계적 치료의 대조군을 비교한 다기관연구는 약 89%의 6개월 생존율을 보여 직접 비교에 한계가 있지만 33%로 알려진 대조군보다 좋은 예후를 보였다[69]. 고식적인 대조군은 글루코코티코이드 이외의 면역억제제 추가까지 걸린 시간이 초기 병합요법군보다 약 20일 차이가 났는데, 이는 단지 몇 주 정도의 치료지연도 anti-MDA-5-positive DM의 예후에 큰 영향을 줄 수 있으며, 빠른 면역조절 치료로 예후의 향상을 기대할 수 있음을 시사한다. 야누스인산화효소억제제(Jaunus kinase inhibitor)인 tofacitinib의 anti-MDA-5-positive RP-ILD에서 효과에 대한 사례군 연구들도 보고되었는데, 고식적인 복합면역억제 조절치료에 반응하지 않는 중증 환자를 대상으로 tofacitinib (5 mg 하루 2회) 병합은 기존 자료보다 개선된 생존율 효과를 보고하였다[70,71].
비약물적 치료
사이질폐질환 환자에게 가장 흔한 증상은 기침, 호흡곤란, 피로감 및 우울감 등이며 이로 인해 삶의 질의 저하되고 운동능력이 감소하여 결과적으로 일상생활의 제한에 이르게 된다. 이에 더해서 자가면역질환에 따른 관절 통증, 부종 및 경직 등의 증상과, 치료에서 주로 사용되는 스테로이드 및 면역억제제 등에 의한 근소실 등의 부작용은 자가면역 관련 사이질폐질환 환자에게 일상생활 및 운동능력을 제한하는 원인이 된다. 아직까지 자료는 부족하지만, 자가면역 관련 사이질폐질환 환자가 포함된 60명의 사이질폐질환 환자를 대상으로 한 무작위대조군연구에서 6개월 간의 운동치료를 포함한 호흡재활은 대조군에 비해 환자의 운동능력, 삶의 질 및 근력을 향상시키는 효과를 보였고, 이러한 효과는 약 1년간 지속되었다[72]. 환자의 상태와 운동능력을 고려해서 가능하다면 환자에 대한 교육과 심리 및 영양 상담과 더불어 적극적인 호흡재활 치료를 고려해야 할 것이다[72,73]. 폐기능의 저하로 안정 시 저산소증이 있거나 또는 운동 시 발생하는 저산소증이 있는 경우 장기간 산소투여를 고려할 수 있다. 이러한 산소치료는 증상 호전 및 환자의 삶의 질 향상에 효과가 있으며, 국제 지침에서도 안정 시 동맥혈 산소분압이 최소 55 mmHg 이하이거나, 55-60 mmHg 사이면서 울혈성심부전을 시사하는 말초부종, 적혈구증가증(적혈구용적률 55% 이상) 및 폐고혈압이 동반된 경우에는 장기간 산소투여를 권고하였다[74,75].
결론
자가면역 관련 사이질폐질환 환자의 치료는 글루코코티코이드를 포함한 면역억제제가 우선적으로 고려되어야 한다. 잘 계획된 무작위대조군연구가 부족하여 확립된 표준 치료는 없지만, 스테로이드와 면역억제제의 부작용을 고려하여 전문가의 판단에 따라 치료 시작 여부, 치료기간, 치료약제 및 용량의 선택이 결정되어야 한다. 면역억제제 중에서 국내에서는 아자싸이오프린, 사이클로포스퍼마이드, mycophenolate mofetil, tacrolimus 등을 사용할 수 있고, 최근의 연구결과에 따라 진행성섬유화 사이질폐질환과 전신경화증의 경우 항섬유화제인 닌테다닙의 사용을 고려할 수 있다. 류마티스관절염 환자에서 폐부작용 및 사이질폐질환을 유발한다고 알려졌던 MTX는 폐부작용이 드물고 사이질폐질환과의 상관관계도 낮다는 연구결과들이 보고되었다. 하지만 RA-ILD 및 MTX-pneumonitis 병력이 있는 환자에게는 신중한 사용이 필요하다. 최근 생물학적제제에 대한 연구가 활발히 이루어지고 있고 긍정적인 효과에 대한 보고가 있지만 효과를 입증하기 위한 추가적인 연구가 필요하다. 이러한 약물 치료 이외에도 증상, 삶의 질 및 운동능력 향상을 위해서 장기간 산소 및 호흡재활 치료가 병행되어야 한다. 이전과 비교해서 빠르게 발전하는 기초 및 임상의학을 바탕으로 새로운 약제 및 치료에 대한 연구가 많이 이루어지고 있기 때문에, 앞으로 많은 자가면역 관련 사이질폐질환 환자들에게 도움을 줄 수 있는 치료의 발전을 기대한다.
Notes
Conflict of Interest
No potential conflict of interest relevant to this article was reported.
References
Peer Reviewers’ Commentary
기저질환으로 자가면역질환이 있는 환자에게서 사이질폐질환이 발생한 경우인 자가면역관련 사이질폐질환은 전체 사이질폐질환의 약 20%를 차지하며, 대표적인 특발성사이질폐질환인 특발성폐섬유증에 비해 예후가 양호한 것으로 알려져 있다. 이 논문은 자가면역관련 사이질폐질환 치료에 관한 최신 지식과 함께 국내에서 가능한 치료법에 대해 잘 설명해 주고 있다. 특히 진단 및 치료를 결정하는 과정에 대해 그림을 이용해 이해하기 쉽게 기술하였으며, 다양한 치료약제의 기전, 임상 연구 결과에 대해서도 상세히 기술하고 있어 임상 현장에서 환자의 치료제를 결정하고, 향후 기대되는 치료 방향을 예측하는 데 많은 도움이 될 것으로 기대된다. 또한 약물 치료 외 증상과 삶의 질 향상을 위한 여러 비약물적인 치료에 대해서도 잘 정리하고 있어 환자들에게도 많은 도움을 줄 것으로 판단된다.
[정리: 편집위원회]

