|
 |
- Search
| J Korean Med Assoc > Volume 66(12); 2023 > Article |
|
Abstract
Background: Recent advances in molecular biology and genomics have revolutionized the understanding of the intricate molecular underpinnings of cancer. Next-generation sequencing analysis now allows identification of specific actionable genetic alterations. This breakthrough has paved the way for precision medicine in oncology, redefining the conventional clinical trial landscape and enabling personalized approaches to cancer treatment.
Current Concepts: The shift toward precision medicine involves a fundamental departure from the traditional Phases 1-4 clinical trial protocols. Instead of using uniform treatment pathways, personalized therapies are designed based on the genetic profiles of individual patients. Tumor-agnostic clinical trials are becoming as a prominent concept, encompassing innovative adaptive designs that adapt treatments to specific genetic variations. Master protocols such as umbrella studies, basket trials, platform studies, and master observational trials exemplify this transformation.
Discussion and Conclusion: International precision medicine research is characterized by exemplar studies such as the NCI-MATCH study in the United States, the Drug Rediscovery Protocol study in the Netherlands, and the Targeted Agent and Profiling Utilization Registry study in the United States. Korean oncology research also contributed to the international effort in precision medicine through initiatives like K-MASTER and the Korean Precision Medicine Networking Group, which is making commendable contributions to the global precision medicine movements.
Current Concepts: The shift toward precision medicine involves a fundamental departure from the traditional Phases 1-4 clinical trial protocols. Instead of using uniform treatment pathways, personalized therapies are designed based on the genetic profiles of individual patients. Tumor-agnostic clinical trials are becoming as a prominent concept, encompassing innovative adaptive designs that adapt treatments to specific genetic variations. Master protocols such as umbrella studies, basket trials, platform studies, and master observational trials exemplify this transformation.
Discussion and Conclusion: International precision medicine research is characterized by exemplar studies such as the NCI-MATCH study in the United States, the Drug Rediscovery Protocol study in the Netherlands, and the Targeted Agent and Profiling Utilization Registry study in the United States. Korean oncology research also contributed to the international effort in precision medicine through initiatives like K-MASTER and the Korean Precision Medicine Networking Group, which is making commendable contributions to the global precision medicine movements.
최근 분자생물학과 유전체학의 급속한 발전은 현대 의학과 생명 과학 분야에 혁명적인 변화를 가지고 오고 있다. 이러한 발전은 암의 복잡한 분자적 특성을 더 잘 이해하고, 정밀의학 분야에서 차세대 염기서열 분석(next generation sequencing, NGS) 검사를 통해 발견된 유전자 변이에 대해 표적치료 및 면역치료의 가능성을 열었다[1-5]. 전통적인 1, 2, 3상 임상시험 프로토콜을 대체하는 다양한 임상시험 설계가 더욱 효과적인 신약 개발 및 승인을 가속화하는 데 기여하고 있다. 현재 암의 종류에 무관한 유전자 중심 임상시험이 주목받고 있으며, 환자의 개별 유전자 변이를 고려한 정밀의료 치료 전략이 진화하고 있다. 국내에서는 2017년부터 NGS 검사법이 보험 급여가 적용되어 정밀의료 분야에서 큰 진전을 나타내고 있다. 이로 인해 환자의 유전자 변이 및 특성에 따라 맞춤형 치료 옵션을 제공할 수 있게 되었고, 국내에서의 정밀의료와 암 치료 연구가 활발하게 진행되고 있다.
과거에는 전통적인 임상시험 설계가 널리 사용되어 왔으며, 이 과정에는 1상, 2상, 3상, 4상의 임상시험이 포함된다[6]. 1상 임상시험은 소수의 환자를 대상으로 하며 의약품의 안전성(safety)과 용량을 결정하는 데 사용된다. 2상 임상시험은 의약품의 효능(efficacy)과 독성(toxicity)을 조사하고, 3상 무작위 대조 임상시험은 대규모의 환자집단을 대상으로 임상시험용 의약품을 기존의 표준 치료를 비교하여 치료의 효과를 입증하는 데 사용되었다. 4상 임상시험은 규제 당국의 승인을 받은 이후에 약물의 장기적인 안전성과 효능을 평가하는 과정이다. 이러한 과정은 과거에는 상당한 시간과 비용이 소요되어 1상부터 미국 식품의약국(Food and Drug Administration, FDA) 승인까지 약 12년 정도가 필요했지만, 최근 몇 년 동안 이러한 과정이 단축되고 있다[2]. 또한 전통적으로 FDA는 전통적으로 3상 무작위 대조 임상시험을 거쳐 의약품을 승인했지만, 최근에는 특정 유전자를 지닌 특정 환자군에서 높은 반응률(objective response rate, ORR)을 보일 경우, 1상 임상시험만으로도 의약품의 신속한 승인이 가능해지고 있다. 이러한 변화는 의약품의 신속한 개발과 정밀의료의 발전을 가속화하고 있다.
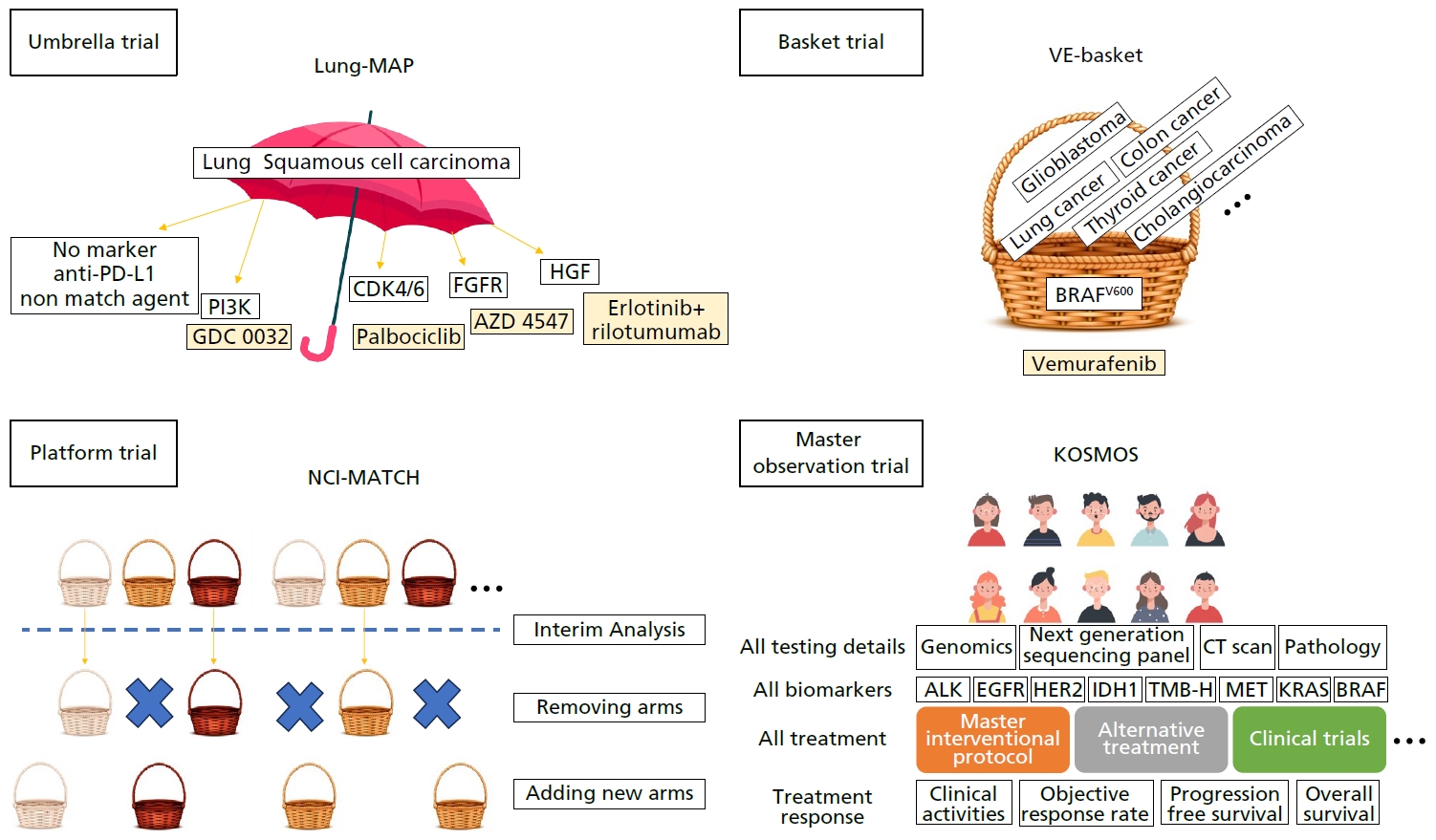
최근의 임상연구 설계는 기존의 임상시험 설계와는 다른 혁신적인 방향으로 진화하고 있다. 유전자 변이에 따라 표적항암치료 또는 면역항암치료를 적용하는 정밀 종양학 임상시험이 진행되고 있다. 다양한 혁신적인 임상시험 디자인이 도입되어 의약품 개발과 승인 과정을 변화시키고 있다. 마스터 프로토콜은 이러한 혁신적인 연구 설계 중 하나로, 여러 치료군을 하나 이상의 암종에 대해 동시에 평가하는 방법이다. 마스터 프로토콜은 크게 마스터 중재연구와 마스터 관찰연구로 나뉜다. 마스터 중재연구의 방법으로는 우산형 임상시험(umbrella study), 바구니 임상시험(basket trial), 플랫폼 연구가 포함된다(Figure 1). 이러한 프로토콜은 독립적인 시험군을 가지며 종양학 영역에서는 유전자 변이에 따라 계층화된 다양한 표적치료법을 평가하는 데 사용된다.
바구니 임상시험은 여러 유형의 암종에 대해 하나의 유전자 이상에 대한 치료법의 효능을 평가하는 혁신적인 연구 설계이다. 이러한 연구 설계를 통해 특정 유전자 이상을 가진 환자군을 대상으로 한 치료법의 효능을 탐구하고, 이로부터 새로운 치료법 및 의약품을 개발할 수 있다. 현재 30가지가 넘는 바스켓 임상시험이 진행 중이다. VE-Basket [10], KEYNOTE-016 [11], KEYNOTE-164 [12], KEYNOTE-012 [13], KEYNOTE-028 [14], and KEYNOTE-158 [15], ROAR [16], ARROW [17], LIBETTO-001 [18,19] 등이 그 예시이다. 이러한 연구 결과를 통해 2017년 5월부터 2022년 9월까지 암종과 무관하게 특정 바이오마커를 가진 환자군에서 총 7건의 약물 승인을 이끌어냈다는 사실은 암 치료 분야에서의 혁신과 진전을 보여주는 주요한 성과이다(Table 1) [15,18,20-24].
플랫폼 연구는 다수의 하위 중재 그룹에서 동시에 여러 가설을 평가하는 포괄적인 단일 임상시험이다. 이러한 연구 방법은 여러 가설을 동시에 검증하고, 중재 그룹에서 다양한 치료 전략을 비교하여 최적의 치료 방법을 찾는 데 기여한다. 중간 분석 결과에 따라 시험군을 확장하거나 삭제할 수 있는 적응형 베이지안(Baysian) 알고리즘을 활용한다[25]. 또한 공통 대조군을 공유하여 더 많은 환자를 중재 및 시험군에 등록할 수 있어 기존의 고전적인 임상시험 방식과 비교하여 더 효율적인 환자 모집 및 연구 진행을 가능하게 한다. Initiative for Molecular Profiling and Advanced Cancer Therapy (IMPACT) 1 [26,27], IMPACT2 [28], Molecular Profiling-based Assignment of Cancer Therapy (NCIMPACT) [29], Molecular Analysis for Therapy Choice (NCI-MATCH) [30], Targeted Agent and Profiling Utilization Registry (TAPUR) [31], Integrated Precision Cancer Medicine Trial (I-PRECICT) [32], Dual AntiCTLA-4 and Anti-PD-1 blockade in Rare Tumors (DART) study [33], Systemic Therapy in Advancing or Metastatic Prostate Cancer: Evaluation of Drug Efficacy (STAMPEDE) trial [34]과 같은 다양한 플랫폼 연구가 진행 중이며 이러한 플랫폼 연구를 통해 암 치료에 대한 새로운 치료법 및 치료 전략의 개발을 가속화하고 개별 환자에 맞는 정밀의학을 실현하고 있다.
마스터 관찰연구는 마스터 중재연구, 전향적 관찰연구 및 유전체 데이터를 통합하여 각 환자에 대한 포괄적인 데이터를 수집하는 전향적 관찰연구이다. 유전자 변이에 관계없이 환자를 등록하고 유전자 기반 마스터 중재연구와 실제 임상데이터를 결합하여 데이터를 분석한다[35]. The Master Registry of Oncology Outcomes Associated with Testing and Treatment (ROOT) 연구는 이러한 마스터 관찰연구의 첫 번째 사례로, 해당 연구를 통해 희귀 유전자 변이나 희귀 암에 관한 리얼월드(real world data) 데이터를 수집하며, 다양한 치료법의 효능, 독성 및 결과 데이터를 평가할 수 있다(NCT04028479). 국내에서도 Korean Precision Medicine Networking Group study of molecular profiling guided therapy based on genomic alterations in advanced solid tumors (KOSMOS) 마스터 관찰연구를 진행하고 환자의 데이터를 분석하고 다양한 치료 방법의 효과를 평가하고 있다[36].
다양한 국가와 연구 그룹에서 진행된 국제적 정밀의료 임상연구 중 대표적인 연구에 대해 소개하겠다(Figure 2).
IMPACT1 연구[26,27]는 2007년에 시작된 최초의 정밀 의료 임상연구로 유전자 변이에 따라 맞춤 치료를 받는 환자군과 유전자 변이에 관계없이 치료를 받은 환자군을 비교하여 분석하였다. 이 연구 결과 유전자 변이에 따라 치료를 받은 환자군에서 그렇지 않은 환자군보다 반응률이 높고(16.4% vs. 5.4%), 무진행 생존기간이 증가하며(4.0개월 vs. 2.8개월), 10년 전체 생존율이 향상되었다(6% vs. 1%). 이는 정밀의료 및 유전자 기반 치료의 중요성을 보여준 첫 번째 연구이다. 이후 2014년에 IMPACT2 연구[28]가 현재까지 진행 중이다.
2015년부터 2023년 1월까지 미국 국립 암 연구소(National Cancer Institute, NCI) 주관으로 NCI-MATCH 연구[30]가 진행되었다. 이 연구는 이미 치료를 받은 암 환자에서 특정 유전자 변이를 표적으로 하는 치료법의 효능을 평가하는 연구로 일차 평가 변수는 반응률(ORR)이다. 이 연구는 2상 플랫폼 연구로, 초기 3개월 동안 10개의 치료군에서 진행되었으며, 이후에는 24개의 치료군으로 확장되었다. 이후 계속해서 새로운 치료군이 추가되어 현재는 총 38개의 하위 연구(subprotocol)가 존재한다. 현재까지 약 6,000명이 스크리닝되었고, 사용가능한 치료군이 증가함에 따라 치료 배정률이 최대 8%에서 17.8%로 증가되었다. 1,593명의 환자가 연구에 등록되어 치료를 받았으며, 환자 중 38%는 유전자 변이를 가지고 있었고 환자의 17%는 치료군에 등록이 되었다. 전체 코호트에서 반응률(ORR)은 10.3%로 보고되었다.
현재까지 27개의 코호트의 결과가 발표되었으며, 이중 7개의 연구는 효과가 있는 것으로 보고되었고, 20개는 효과가 없다고 보고되었다. 추가적인 연구 결과는 차후 발표될 예정이며 효과가 있었던 7개의 치료군은 다음과 같다. (1) deficient in mismatch repair (dMMR)/high microsatellite instability (MSI-H) non-colorectal cancer에서 nivolumab [38], (2) AKT1 E171K 변이가 있는 환자에서 capivarsertib [39], (3) BRAFV600E에서 dabrafenib+trametinib [24], (4) PIK3CA mutation에서 copanlisib [40], (5) ALK fusion에서 crizotinib [41], (6) FGFR mutation/fusion에서 erdafitinib [42], (7) AKT mutation에서 Ipatasertib [43].
TAPUR 연구[31]는 2016년부터 미국에서 진행되는 2상, 비무작위, 오픈라벨 임상시험이며, 미국 임상종양학회(American Society of Clinical Oncology, ASCO)에서 진행된 첫 번째 정밀의료 임상연구이다. 총 3,860명이 스크리닝되었고, 2023년 5월까지 68.7%인, 2,652명이 치료를 받았다. 환자는 종양 유형, 유전자 변이, 연구 약물에 따라 정의된 코호트에 등록된다. 초기에 13개의 치료군에서 시작되어, 계속해서 새로운 치료군이 추가되며, 2023년 9월 22일 현재 16가지의 단일 혹은 조합요법에 대해 50개의 코호트가 등록이 종료되었고 45개의 코호트에서 연구가 진행 중이다.
처음에는 최대 10명의 참가자가 코호트에 등록되어 완전 반응(complete response) 또는 부분 반응(partial response) 또는 16주 이상의 안정병변(stable disease)을 평가한다. 성공적인 결과를 얻은 참가자가 2명 미만인 경우, 코호트는 영구적으로 폐쇄되어 추가 등록이 불가능하다. 2명 이상의 참가자가 성공적인 결과를 얻은 경우, 코호트를 확장하여 18명의 참가자를 추가로 등록한다. 코호트의 완전한 데이터가 확보되면 TAPUR 연구 데이터 및 안전성 모니터 위원회에서 코호트 결과를 검토한다. 28명의 참가자 중 최소 7명 이상이 치료 반응을 보이거나 최소 16주 동안 종양이 성장하지 않는 경우, 약물 활성이 있는 것으로 간주한다. 일차 평가 변수는 완전 반응 또는 부분 반응 또는 16주 이상의 안정병변 비율이고 이차 평가 변수는 전체 생존기간이다.
50개의 코호트 중 21개의 코호트에서 유전자 변이에 따른 약제의 활성이 나타났고, 15개의 코호트에서는 약제의 활성이 나타나지 않았으며, 14개의 코호트는 결과가 보고되지 않았다. 활성이 나타난 21개의 코호트와 암종, 유전자이상은 다음과 같다. (1) Olaparib: ① 고형암, ATM 변이 또는 결실(AACR 2022) [44]; ② 전립샘암, BRCA1/2 변이(ASCO202) [45]; ③ 췌장암, BRACA1/2 변이(ASCO 2020) [46]; ④ 고형암, 생식세포 또는 체세포 BRCA1/2 비활성화 변이(ESMO2022) [47]. (2) Palbociclib: ① 두경부암, CDKN2A 변이 또는 결실(ASCO2021) [48]; ② 비소세포폐암, CDKN2A 변이(ASCO 2019, JCO PO 2020) [49]; ③ 연부조직육종, CDK 4 증폭(ASCO 2021) [50]. (3) Pertuzumab+trastuzumab: ① 대장암, ERBB2 증폭 또는 과발현(ASCO GI2020) [51]; ② 비소세포폐암, ERBB2 증폭, 변이, 또는 과발현(2022 ESMO, 2023 KCOPO) [52]; ③ 자궁암, ERBB2 증폭, 변이, 또는 과발현(2021 ASCO) [53]; ④ 담도암, ERBB2 증폭 또는 과발현(ASCO GI 2023) [54]. (4) Pembrolizumab: ① 유방암, high TMB (ASCO 2019) [55]; ② 대장암, high Tumor mutation burden (TMB) (ASCO GI 2020) [56]; ③ 고형암, high TMB JCO 2023 [57]. (5) Sunitinib: 유방암 FGFR1 mutation or amplification (AACR 2021) [58]. (6) Talazoparib: 고형 암, 생식세포 또는 체세포 BRCA1/BRCA2 변이(ASCO 2023) [59]. (7) Temsirolimus: ① 고형암 mTOR 변이 (ASCO 2022) [60]; ② 고형암, PIK3CA 변이(ASCO 2023) [61]; ③ 고형암 PTEN 변이(AACR 2023) [62]. (8) Vemurafenib+cobimetinib: ① 대장암, BRAFV600E/D/K/R (ASCO GI 2020) [63]; ② 고형암, BRAFV600E/D/K/R (ASCO2022) [64]. 더 많은 세부 정보 및 연구 결과에 대한 자세한 내용은 연구의 공식 웹사이트(https://old-prod.asco.org/research-data/tapur-study/study-results)에서 확인할 수 있다.
2016년부터 시작된 The Drug Rediscovery Protocol (DRUP) 연구[65]는 유럽의 네덜란드에서 진행 중이다. 치료 불응성 전이성 암 환자중 치료 가능한 분자 프로필을 가진 환자에게 FDA 혹은 European Medicines Agency에 승인된 표적항암제와 면역항암제를 허가사항/적응증 이외의 목적으로 사용하여 임상적 혜택을 확인하는 것이 DRUP 연구의 목표이다. DRUP 연구는 1단계에 8명의 환자가 등록되고, 2단계에 최대 24명의 환자를 등록하는 사이먼과 유사한 2단계 설계의 적응형 임상연구이다. 1단계에서 완전 반응 또는 부분 반응 또는 16주 이상의 안정병변으로 정의된 임상적 혜택(clinical benefit)이 최소 1회 관찰되는 경우 2단계로 진행된다. 2단계에서 24명 중 5명에서 임상적 혜택이 있는 경우 환자수를 추가로 확장한다. DRUP 연구에 참여하는 모든 환자는 항암치료를 시작하기 전에 전장 유전체 염기서열 분석(whole genome sequencing)을 시행하였으며, 환자는 암의 종류, 유전자 프로파일, 투여 약물에 따라 37개의 병렬 코호트에 배정되고 병렬 코호트의 수를 무제한으로 확장할 수 있다.
현재까지 약 52%의 환자들이 유전자 기반의 치료를 받았고, 이러한 연구를 통해 기존의 약물을 다시 활용하고 임상 혜택을 식별하는 데 중요한 성과를 얻고 있다.
2017년 6월부터 시작된 전국적인 다기관 정밀 종양학 스크리닝 프로그램인 K-MASTER 연구[66]는 한국인 진행성 고형암 환자의 유전체를 전향적으로 수집하고 분석하여 임상적 유용성을 연구하였다. 또한 표준 치료에 실패한 암 환자들을 대상으로 20개의 서로 다른 임상시험을 통해 표적항암제의 효능을 평가하고, 이를 통해 개별 환자에게 맞춤형 치료 전략을 개발하는 데 기여하고자 하였다. K-MASTER 연구는 한국인 암 환자 유전체 정보를 활용한 기반을 구축함으로써 국내 정밀의료 분야의 발전과 확대에 기여하고 있다.
대한종양내과학회(Korean Society of Medical Oncology)와 대한항암요법연구회(Korean Cancer Study Group)는 정밀의료의 실현을 위해 Korean Precision Medicine Networking Group을 설립하고, 마스터 관찰연구인 KOSMOS 연구[36]를 기획하여 1,000명의 고형암 환자에게 임상연구 참여 기회를 제공하고 있다. 다양한 암 전문가들—종양내과 전문의, 병리학자, 생물정보학자 등—이 모여 분자 종양위원회(Molecular Tumor Board)를 구성하고, 분자 종양위원회에서 환자의 NGS 검사 결과와 임상 정보를 분석하고 환자에게 가장 적합한 치료 방법을 권고한다. 환자들은 분자 종양위원회의 권고에 따라 임상시험에 참여하거나, KOSMOS에서 제약사의 지원을 받아 공급하는 임상시험용 의약품으로 치료받거나 다른 항암제 등을 이용한 정밀의료를 받는다. KOSMOS 연구는 NGS 결과와 임상 정보, 치료 결과를 수집하여 공공 데이터베이스를 구축하고 있으며, 이를 통해 암 예후 분석 및 치료법 연구에 활용될 수 있으며 국내 암 환자들에게 정밀의료를 제공하고 환자 중심 맞춤 치료 전략을 실현하는 데 중요한 역할을 하고 있다(Figure 2).
지난 30년 동안 과학 연구는 놀라운 발전을 거듭해 왔다. 암 치료 분야에서의 정밀의학의 발전은 매우 중요하며, 인공지능, 머신러닝, 다중 오믹스 데이터를 활용한 복잡한 질병 이해에 대한 혁신적인 기술과 연구를 통해 환자 중심의 치료 전략을 실현하는 데 크게 기여하고 있다. 그러나 이러한 발전에도 불구하고, 여전히 많은 암 환자들은 정밀 종양학에 접근하지 못하는 상황에 처해있다. 유전자 변이를 찾아내고 그 의미를 해석하는 일이 매우 복잡하며, 또 유전자 변이가 있더라도 참여 가능한 임상연구가 없는 한 환자는 유전자 검사 기반의 치료를 받을 수 없다. 따라서 정밀의료 약물 사용의 효과와 안정성을 평가하고 새로운 암 치료법을 개발할 수 있는 전국 단위 정밀의료 플랫폼과 임상시험, 약제 공급이 필요하다. 또한 임상의사의 교육과 훈련, 올바른 분자 플랫폼 선택, 유전자 검사 소요 시간 단축, 의약품 접근성, 오프라벨 사용 등 규제 문제를 해결하는 것이 중요하다.
유전자 검사를 활용한 암 임상연구는 현재 암 치료 분야에서 가장 중요한 동향 중 하나이다. 이러한 국내 및 국제적 임상연구 결과를 활용하여 암 환자들에게 더 나은 치료 옵션을 제공할 것으로 기대된다. 정밀 종양학의 시대에서는 유전자 변이를 찾아내고 의미를 해석하며 임상연구에 참여하는 과정이 매우 중요하다. 이러한 이유로 항암치료의 최신 지표를 정확하게 평가하고 환자에게 최적의 치료 계획을 제공하기 위해서는 종양내과와 병리학자, 생물정보학자 기반의 분자 종양위원회의 역할이 향후 더욱 중요하게 부각될 것으로 예상된다. 종양내과에서 제공되는 정밀의료는 종양의 특성과 환자의 유전적 프로파일을 고려하여 설계되며, 이는 앞으로 환자의 생존율과 삶의 질을 향상시키는 데 큰 기여를 할 수 있을 것이라 생각한다.
Figure 1.
Global Precision Oncology Initiatives: Advancing Cancer Care Worldwide. IMPACT, Initiative for Molecular Profiling and Advanced Cancer Therapy; TAPUR, Targeted Agent and Profiling Utilization Registry; DRUP, The Drug Rediscovery Protocol. Designed by Freepik
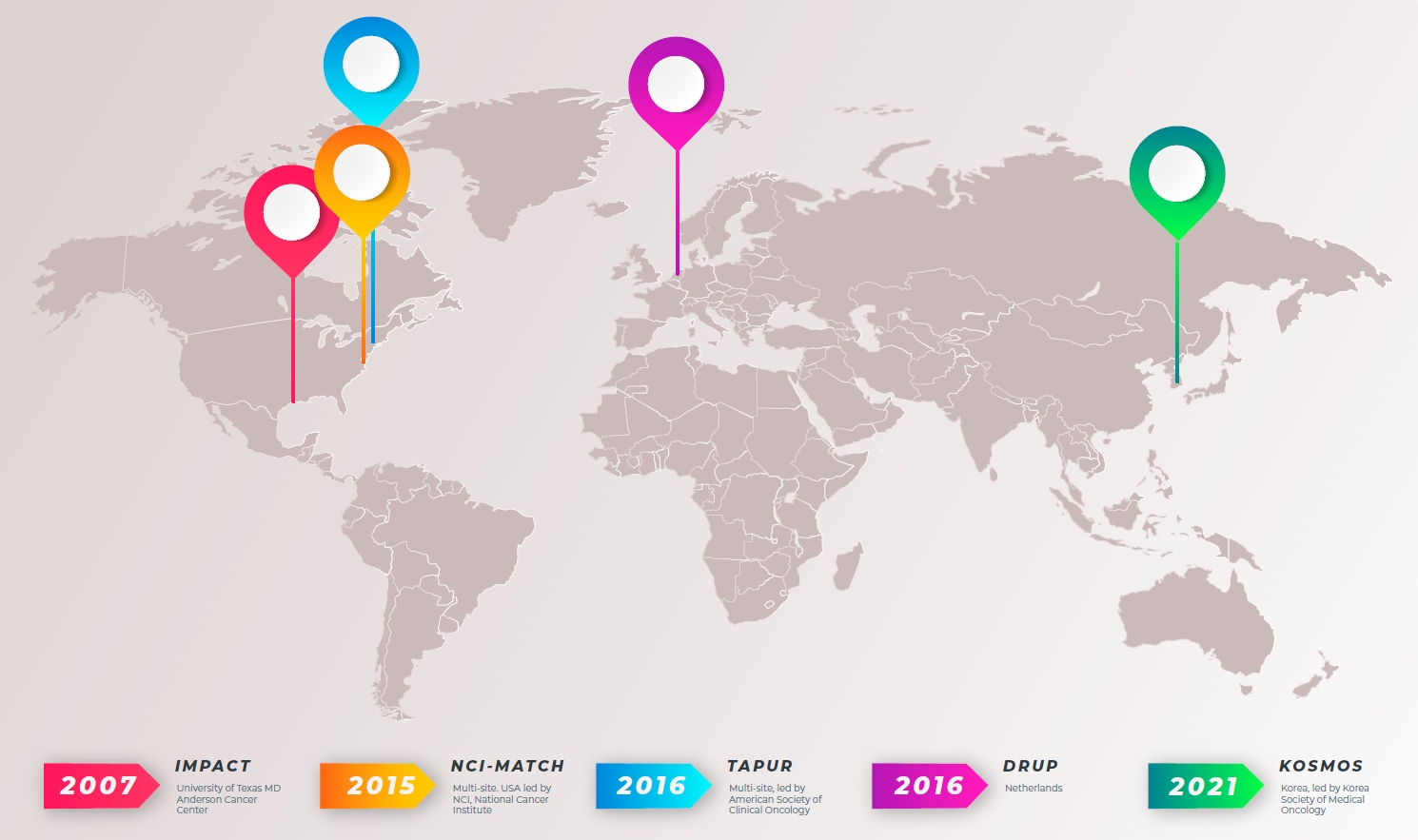
Table 1.
Approved tissue-agnostic therapies Therapies in 2023
| Treatment | Histology-agnostic indication | FDA approval date | Response rate (%) |
|---|---|---|---|
| Pembrolizumab [15] | Unresectable/metastatic MSI-H or dMMR solid tumors that progressed after previous treatment with no satisfactory alternative treatment options | May 2017 | 40 (n = 59) |
| Pembrolizumab [20] | Unresectable/metastatic TMB-H (≥10 mut/Mb) solid tumors that progressed after previous treatment with no satisfactory alternative treatment options | June 2020 | 29 (n = 102) |
| Dostarlimab [21] | Recurrent/advanced dMMR solid tumors that progressed on or after previous treatment with no satisfactory alternative treatment options | August 2021 | 42 (n = 209) |
| Entrectinib [22] | Unresectable/metastatic NTRK gene fusion-positive solid tumors without a known acquired resistance mutation that progressed after previous treatment or with no satisfactory alternative treatment options | August 2019 | 57 (n = 54) |
| Larotrectinib [23] | Unresectable/metastatic NTRK gene fusion-positive solid tumors without a known acquired resistance mutation that progressed after previous treatment or with no satisfactory alternative treatment options | November 2018 | 75 (n = 55) |
| Dabrafenib+trametinib [24] | Unresectable/metastatic solid tumors with BRAFV600E mutation that progressed after previous treatment with no satisfactory alternative treatment options | June 2022 | 41 (n = 131) |
| Selpercatinib [18] | Locally advanced/metastatic solid tumors with a RET gene fusion that progressed on or after previous treatment or with no satisfactory alternative treatment options | September 2022 | 44 (n = 41) |
References
1. Bedard PL, Hyman DM, Davids MS, Siu LL. Small molecules, big impact: 20 years of targeted therapy in oncology. Lancet 2020;395:1078-1088.


2. Subbiah V, Wirth LJ, Kurzrock R, et al. Accelerated approvals hit the target in precision oncology. Nat Med 2022;28:1976-1979.



3. Cohen P, Cross D, Jänne PA. Kinase drug discovery 20 years after imatinib: progress and future directions. Nat Rev Drug Discov 2021;20:551-569.




5. Korman AJ, Garrett-Thomson SC, Lonberg N. The foundations of immune checkpoint blockade and the ipilimumab approval decennial. Nat Rev Drug Discov 2022;21:509-528.



6. Van Norman GA. Drugs, devices, and the FDA: Part 1: an overview of approval processes for drugs. JACC Basic Transl Sci 2016;1:170-179.


7. Herbst RS, Gandara DR, Hirsch FR, et al. Lung Master Protocol (Lung-MAP): a biomarker-driven protocol for accelerating development of therapies for squamous cell lung cancer: SWOG S1400. Clin Cancer Res 2015;21:1514-1524.




8. Govindan R, Mandrekar SJ, Gerber DE, et al. ALCHEMIST trials: a golden opportunity to transform outcomes in early-stage non-small cell lung cancer. Clin Cancer Res 2015;21:5439-5444.




9. Turner NC, Kingston B, Kilburn LS, et al. Circulating tumour DNA analysis to direct therapy in advanced breast cancer (plasmaMATCH): a multicentre, multicohort, phase 2a, platform trial. Lancet Oncol 2020;21:1296-1308.



10. Subbiah V, Puzanov I, Blay JY, et al. Pan-cancer efficacy of vemurafenib in BRAFV600-mutant non-melanoma cancers. Cancer Discov 2020;10:657-663.




11. Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015;372:2509-2520.


12. Le DT, Kim TW, Van Cutsem E, et al. Phase II open-label study of pembrolizumab in treatment-refractory, microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: KEYNOTE-164. J Clin Oncol 2020;38:11-19.


13. Muro K, Chung HC, Shankaran V, et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncol 2016;17:717-726.


14. O’Neil BH, Wallmark JM, Lorente D, et al. Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with advanced colorectal carcinoma. PLoS One 2017;12:e0189848.



15. Marabelle A, Le DT, Ascierto PA, et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 study. J Clin Oncol 2020;38:1-10.

16. Subbiah V, Kreitman RJ, Wainberg ZA, et al. Dabrafenib plus trametinib in BRAFV600E-mutated rare cancers: the phase 2 ROAR trial. Nat Med 2023;29:1103-1112.




17. Subbiah V, Cassier PA, Siena S, et al. Pan-cancer efficacy of pralsetinib in patients with RET fusion-positive solid tumors from the phase 1/2 ARROW trial. Nat Med 2022;28:1640-1645.




18. Subbiah V, Wolf J, Konda B, et al. Tumour-agnostic efficacy and safety of selpercatinib in patients with RET fusion-positive solid tumours other than lung or thyroid tumours (LIBRETTO-001): a phase 1/2, open-label, basket trial. Lancet Oncol 2022;23:1261-1273.


19. Drilon A, Oxnard GR, Tan DS, et al. Efficacy of selpercatinib in RET fusion-positive non-small-cell lung cancer. N Engl J Med 2020;383:813-824.


20. Marabelle A, Fakih M, Lopez J, et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol 2020;21:1353-1365.


21. Berton D, Banerjee SN, Curigliano G, et al. Antitumor activity of dostarlimab in patients with mismatch repair-deficient/ microsatellite instability-high tumors: a combined analysis of two cohorts in the GARNET study. J Clin Oncol 2021;39((15 suppl):2564.



22. Doebele RC, Drilon A, Paz-Ares L, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020;21:271-282.


23. Drilon A, Laetsch TW, Kummar S, et al. Efficacy of larotrectinib in TRK fusion-positive cancers in adults and children. N Engl J Med 2018;378:731-739.


24. Salama AK, Li S, Macrae ER, et al. Dabrafenib and trametinib in patients with tumors with BRAFV600E mutations: results of the NCI-MATCH trial subprotocol H. J Clin Oncol 2020;38:3895-3904.



25. Barker AD, Sigman CC, Kelloff GJ, Hylton NM, Berry DA, Esserman LJ. I-SPY 2: an adaptive breast cancer trial design in the setting of neoadjuvant chemotherapy. Clin Pharmacol Ther 2009;86:97-100.


26. Tsimberidou AM, Hong DS, Ye Y, et al. Initiative for molecular profiling and advanced cancer therapy (IMPACT): an MD Anderson Precision Medicine Study. JCO Precis Oncol 2017;2017:PO.17.00002.


27. Tsimberidou AM, Hong DS, Wheler JJ, et al. Long-term overall survival and prognostic score predicting survival: the IMPACT study in precision medicine. J Hematol Oncol 2019;12:145.




28. Vo HH, Fu S, Hong DS, et al. Challenges and opportunities associated with the MD Anderson IMPACT2 randomized study in precision oncology. NPJ Precis Oncol 2022;6:78.




29. Chen AP, Kummar S, Moore N, et al. Molecular profiling-based assignment of cancer therapy (NCI-MPACT): a randomized multicenter phase II trial. JCO Precis Oncol 2021;5:PO.20.00372.



30. O'Dwyer PJ, Gray RJ, Flaherty KT, et al. The NCI-MATCH trial: lessons for precision oncology. Nat Med 2023;29:1349-1357.



31. Mangat PK, Halabi S, Bruinooge SS, et al. Rationale and design of the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. JCO Precis Oncol 2018;2018:10.1200/PO.18.00122.
32. Sicklick JK, Kato S, Okamura R, et al. Molecular profiling of cancer patients enables personalized combination therapy: the I-PREDICT study. Nat Med 2019;25:744-750.




33. Patel SP, Othus M, Chae YK, et al. A phase II basket trial of dual anti-CTLA-4 and anti-PD-1 blockade in rare tumors (DART SWOG 1609) in patients with nonpancreatic neuroendocrine tumors. Clin Cancer Res 2020;26:2290-2296.




34. Sydes MR, Spears MR, et al. Adding abiraterone or docetaxel to long-term hormone therapy for prostate cancer: directly randomised data from the STAMPEDE multi-arm, multistage platform protocol. Ann Oncol 2018;29:1235-1248.



35. Dickson D, Johnson J, Bergan R, Owens R, Subbiah V, Kurzrock R. The master observational trial: a new class of master protocol to advance precision medicine. Cell 2020;180:9-14.


36. Kim SY, Kim JH, Kim TY, et al. Korean Precision Medicine Networking Group study of molecular profiling guided therapy based on genomic alterations in advanced solid tumors (KOSMOS) II (KCSG AL 22-09). J Clin Oncol 2023;41((16 suppl):TPS1608.

37. Rodon J, Soria JC, Berger R, et al. Genomic and transcriptomic profiling expands precision cancer medicine: the WINTHER trial. Nat Med 2019;25:751-758.




38. Azad NS, Gray RJ, Overman MJ, et al. Nivolumab is effective in mismatch repair-deficient noncolorectal cancers: results from arm Z1D: a subprotocol of the NCI-MATCH (EAY131) Study. J Clin Oncol 2020;38:214-222.


39. Kalinsky K, Hong F, McCourt CK, et al. Effect of capivasertib in patients with an AKT1 E17K-mutated tumor: NCIMATCH subprotocol EAY131-Y nonrandomized trial. JAMA Oncol 2021;7:271-278.


40. Damodaran S, Zhao F, Deming DA, et al. Phase II study of copanlisib in patients with tumors with PIK3CA mutations: results from the NCI-MATCH ECOG-ACRIN Trial (EAY131) subprotocol Z1F. J Clin Oncol 2022;40:1552-1561.



41. Mansfield AS, Wei Z, Mehra R, et al. Crizotinib in patients with tumors harboring ALK or ROS1 rearrangements in the NCI-MATCH trial. NPJ Precis Oncol 2022;6:13.




42. Lee A, Chou AJ, Williams PM, et al. Erdafitinb in patients with FGFR-altered tumors: results from the NCI-COG Pediatric MATCH trial arm B (APEC1621B). J Clin Oncol 2023;41((16 suppl):10007.

43. Kalinsky K, Zihan W, McCourt C, et al. Ipatasertib in patients with tumors with AKT mutations: results from the NCIMATCH ECOG-ACRIN Trial (EAY131) sub-protocol Z1K. Eur J Cancer 2022;174:S8-S9.

44. Mileham KF, Rothe M, Mangat PK, et al. Abstract CT110: Olaparib (O) in patients (pts) with solid tumors with ATM mutation or deletion: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. Cancer Res 2022;82((12_Supplement):CT110.


45. Yang ES, Halabi S, Rothe M, et al. Olaparib in patients with metastatic prostate cancer with BRCA1/2 mutation: results from the TAPUR study. JCO Precis Oncol 2023;7:e2200505.


46. Ahn ER, Garrett-Mayer E, Halabi S, et al. Olaparib (O) in patients (pts) with pancreatic cancer with BRCA1/2 inactivating mutations: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2020;38((15 suppl):4637.

47. Ahn E, Rothe M, Mangat PK, et al. 98P Olaparib (O) in patients (pts) with solid tumors with BRCA1/2 mutation (mut): results from the targeted agent and profiling utilization registry (TAPUR) study. Ann Oncol 2022;33:S583-S584.

48. Pisick EP, Rothe M, Mangat PK, et al. Palbociclib (P) in patients (pts) with head and neck cancer (HNC) with CDKN2A loss or mutation: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2021;39((15 suppl):6043.

49. Ahn ER, Mangat PK, Garrett-Mayer E, et al. Palbociclib (P) in patients (pts) with non-small cell lung cancer (NSCLC) with CDKN2A alterations: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. J Clin Oncol 2019;37((15 suppl):9041.

50. Schuetze S, Rothe M, Mangat PK, et al. Palbociclib (P) in patients (pts) with soft tissue sarcoma (STS) with CDK4 amplification: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2021;39((15 suppl):11565.

51. Gupta R, Meric-Bernstam F, Rothe M, et al. Pertuzumab plus trastuzumab in patients with colorectal cancer with ERBB2 amplification or ERBB2/3 mutations: results from the TAPUR study. JCO Precis Oncol 2022;6:e2200306.


52. Ganti AK, Rothe M, Mangat PK, et al. Pertuzumab plus trastuzumab in patients with lung cancer with ERBB2 mutation or amplification: results from the targeted agent and profiling utilization registry study. JCO Precis Oncol 2023;7:e2300041.


53. Ali-Ahmad HM, Rothe M, Mangat PK, et al. Pertuzumab plus trastuzumab (P+ T) in patients (Pts) with uterine cancer (UC) with ERBB2 or ERBB3 amplification, overexpression or mutation: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2021;39((15 suppl):5508.

54. Cannon TL, Rothe M, Garrett-Mayer E, et al. Pertuzumab plus trastuzumab (P+ T) in patients (pts) with biliary tract cancer (BTC) with ERBB2/3 amplification (amp), overexpression (oe), or mutation (mut): results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2023;41((4 suppl):546.

55. Alva AS, Mangat PK, Garrett-Mayer E, et al. Pembrolizumab in patients with metastatic breast cancer with high tumor mutational burden: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. J Clin Oncol 2021;39:2443-2451.


56. Meiri E, Garrett-Mayer E, Halabi S, et al. Pembrolizumab (P) in patients (Pts) with colorectal cancer (CRC) with high tumor mutational burden (HTMB): results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. J Clin Oncol 2020;38((4 suppl):133.

57. Duvivier HL, Rothe M, Mangat PK, et al. Pembrolizumab in patients with tumors with high tumor mutational burden: results from the targeted agent and profiling utilization registry study. J Clin Oncol 2023:JCO2300702.

58. Calfa C, Rothe M, Mangat PK, et al. Abstract CT173: Sunitinib (S) in patients (pts) with metastatic breast cancer (mBC) with FGFR1 mutations or amplifications: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. Cancer Res 2021;81((13_Supplement):CT173.


59. Srkalovic G, Rothe M, Mangat PK, et al. Talazoparib (Tala) in patients (pts) with solid tumors with BRCA1/2 mutation (mut): results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2023;41((16 suppl):3115.

60. Srkalovic G, Rothe M, Mangat PK, et al. Temsirolimus (T) in patients (pts) with solid tumors with mTOR mutation: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. J Clin Oncol 2022;40((16 suppl):3114.

61. Calfa CJ, Rothe M, Srkalovic G, et al. Temsirolimus (T) in patients (pts) with solid tumors with PIK3CA mutation (mut): results from the Targeted Agent and Profiling Utilization Registry (TAPUR) study. J Clin Oncol 2023;41((16 suppl):3117.

62. Wentzel K, Rothe M, Mangat PK, et al. Abstract CT231: Temsirolimus (T) in patients (pts) with solid tumors with PTEN mutation (mut): results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. Cancer Res 2023;83((8_Supplement):CT231.


63. Klute KA, Rothe M, Garrett-Mayer E, et al. Cobimetinib plus vemurafenib in patients with colorectal cancer with BRAF mutations: results from the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. JCO Precis Oncol 2022;6:e2200191.


64. Meric-Bernstam F, Rothe M, Garrett-Mayer E, et al. Cobimetinib plus vemurafenib (C+ V) in patients (Pts) with solid tumors with BRAF V600E/d/k/R mutation: results from the targeted agent and profiling utilization registry (TAPUR) study. J Clin Oncol 2022;40((16 suppl):3008.

Peer Reviewers’ Commentary
이 논문은 최근 항암치료의 패러다임을 바꾸고 있는 차세대 염기서열 분석(next generation sequencing)에 기반한 새로운 정밀의료 임상시험의 최신 동향을 정리한 논문이다. 기존의 항암치료는 개인별 암의 생물학적 특징을 반영하지 못하고, 암이 발생한 장기에 따라 같은 방법으로 치료해 왔다. 최근 분자 생물학의 발전, 특히 차세대 염기서열분석 등 진단기법의 발전과 더불어 개인별 암유전자의 이상을 진단하고 이에 따라 맞춤 치료를 적용하는 정밀 종양학이 도입되고 있다. 이 논문은 정밀 종양학의 발전 역사와 임상시험 설계의 유형을 설명하고, 대표적인 국내외 정밀 종양 임상시험을 자세히 소개하고 있어 유전체 검사를 이용한 항암치료의 발전과 변화를 임상 의사들이 이해하고 암 환자를 진료하는 데 좋은 정보를 제공할 것으로 판단된다.
[정리: 편집위원회]
-
METRICS

-
- 0 Crossref
- Scopus
- 832 View
- 152 Download
-
Related articles in
J Korean Med Assoc -
Current state of clinical trials in Korea2010 September;53(9)
Advances in clinical trials technologies2010 September;53(9)