알츠하이머병의 약물요법
Pharmacotherapy for patients with Alzheimer’s disease
Article information
Trans Abstract
Background
Alzheimer’s disease is a neurodegenerative condition characterized by the accumulation of amyloid and tau proteins, leading to neuronal loss, cognitive decline, and difficulties maintaining daily activities. As the elderly population grows, interest in effective Alzheimer’s disease treatment is increasing.
Current Concepts
The recent approval of drugs by the United States Food and Drug Administration with mechanisms based on the amyloid cascade hypothesis, in addition to existing therapies based on the cholinergic hypothesis, raises the possibility of introducing these novel agents in South Korea.
Discussion and Conclusion
Currently, South Korea offers cholinesterase inhibitors and an N-methyl-D-aspartate receptor antagonist based on the cholinergic hypothesis for Alzheimer’s disease dementia. Each drug has different indications under national health insurance coverage depending on dementia severity. The development of new intravenous drugs targeting the amyloid cascade offers potential benefits not only for early-stage Alzheimer’s disease but also for mild cognitive impairment due to Alzheimer’s disease, suggesting a wider scope for future pharmacological intervention.
서론
알츠하이머병 치료제는 1993년 처음 콜린분해효소 억제제인 타크린(tacrine)의 미국 식품의약국(US Food and Drug Administration, FDA) 승인을 시작으로 약물이 개발되다 2003년 메만틴(memantine)이 승인된 이후로는 20년 가까이 신약 승인이 되지 않아 그동안 약물치료에 어려움이 많았었다. 하지만 2023년 아밀로이드(amyloid) 베타 표적 면역치료제인 레카네맙(lecanemab)이 미국 FDA의 정식 승인을 받고 사용되기 시작하면서 치료 치매의 새로운 시대가 열렸다. 아직 국내에서는 레카네맙의 승인이 이루어지지 않아 사용되고 있지는 않으나 현재 임상에서 사용하고 있는 약물치료들을 돌아보고, 향후 사용될 가능성이 있는 레카네맙을 포함한 아밀로이드 베타 표적 면역치료제에 대해서 알아보고자 한다.
알츠하이머병의 진단
알츠하이머병은 신경반(neuritic plaque)과 신경섬유다발(neurofibrillary tangle)의 두 가지 병리 소견을 특징으로 하는 질병으로, 1984년 미국 국립 신경학 장애 및 뇌졸중 연구소 알츠하이머병 및 연관장애협회(National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer’s Disease and Related Disorders Association) 진단 기준이 제안되어 임상 증상에 근거한 유력(probable) 알츠하이머병 진단 기준을 30년 동안 사용하였다[1]. 하지만 임상 증상에만 기반을 한 이 진단 기준은 생체표지자 검출 기술의 발달로 알츠하이머병의 병리 소견을 체내에서 검출할 수 있게 되면서 진단 기준의 정확도가 낮고 특히 특이도가 낮음이 알려져 2011년 미국 국립노화연구소와 알츠하이머협회(National Institute of Aging and Alzheimer Association, NIA-AA)에서 알츠하이머병의 진단 가이드라인을 새롭게 발표하였다[2]. 2011년 발표된 알츠하이머병의 진단 가이드라인은 임상적 증상 발현 정도에 따라 최초로 알츠하이머병을 알츠하이머병 치매, 알츠하이머병에 의한 경도인지장애, 전임상기 알츠하이머병의 세 가지 범주로 구분하여 진단 기준을 제시하였으며, 생체표지자 정보를 진단 가이드라인에 반영하였다. 이후 생체표지자 검출 방법이 좀 더 발달하면서 2018년 NIA-AA에서는 2011년 진단 가이드라인을 바탕으로 좀 더 체계적으로 아밀로이드(amyloid, A), 타우(tau, T), 신경퇴행(neurodegeneration, N)을 나타내는 생체표지자 정보를 반영한 진단 가이드라인 ATN 분류(ATN classification)를 제안하여 현재까지 이 진단 가이드라인을 이용하여 알츠하이머병을 분류하고 있다[3]. 현재까지도 다양한 생체표지자 검출 기술은 지속적으로 발달하고 있어 금년에는 아밀로이드, 타우, 신경퇴행 변화뿐 아니라, 염증, 혈관성 변화 등을 반영한 확장된 ATN 분류를 제안하기도 하였다.
알츠하이머병의 치료
알츠하이머병의 치료제는 콜린 가설(Cholinergic hypothesis)과 아밀로이드 연쇄반응 가설, 두 가지 가설에 근거하여 개발되었다. 현재 임상적으로 사용하고 있는 알츠하이머병 치료제는 모두 콜린 가설에 기반하여 개발된 약물로, 콜린성 신경세포에 신경전달에 작용하는 신경전달 물질인 아세틸콜린(acetylcholine)의 작용을 극대화시키기 위한 약물들이다. 하지만 2023년 아밀로이드 연쇄반응 가설에 기반을 한 약물들이 FDA 승인을 받기 시작하면서 알츠하이머병의 치료제에 새로운 변화가 예고되고 있다.
1. 콜린 가설 기반 치료제
중추신경계의 콜린성 신경세포의 소실로 인해 발생하는 콜린성 기능 감소가 알츠하이머병과 관련된 인지 저하와 관련이 있다는 가설이다[4]. 기저 전뇌(basal forebrain)에서 시작되는 콜린성 신경세포는 대뇌피질과 해마로 연결되는데 콜린성 신경세포가 손상되거나 약물로 인해 기능이 방해되면 기억력 저하가 일어난다는 것이 1970년대부터 알려져 있었다[5]. 따라서 알츠하이머병 환자는 콜린성 신경세포 말단이 위치하고 있는 대뇌피질과 해마에서 신경 퇴행 및 신경세포 소실로 인해 아세틸콜린 결핍이 일어나 기억력 저하가 발생한다[6]. 이 가설을 기반으로 처음 알츠하이머병의 치료제가 개발이 되었고 1993년 타크린이 승인된 이후로, 도네페질(donepezil), 리바스티그민(rivastigmine), 갈란타민(galantamine)의 약제가 개발되었다. 하지만 이들 약물은 알츠하이머병의 기억력 저하 증상 조절에는 효과가 있으나, 경도인지장애에는 효과가 제한적이다. 이는 경도인지장애 환자에서는 콜린성 신경세포의 소실이 관찰되지 않고 오히려 콜린아세틸전달효소(choline acetyltransferase) 활성도가 증가되어 있는 것과 관련이 있을 것으로 생각한다[7].
1) 콜린분해효소 억제제
아세틸콜린의 가수분해를 억제하여 콜린의 신경전달과 시냅스 농도를 증가시키는 약물이다. 1993년 타크린이 처음 승인되었으나, 간독성이 심하여 현재는 승인이 취소된 상태이며, 이후 간독성을 줄인 도네페질, 리바스티그민, 갈란타민이 개발되어 현재까지 사용 중이다.
(1) 도네페질
1996년 FDA 승인을 받은 약제로 콜린분해효소 억제 작용을 한다. 하루 5 mg의 용량으로 시작하여 4-6주 후에 10 mg의 용량으로 증량하여 사용한다. 2018년 23 mg 제형이 출시되어 10 mg의 용량으로도 효과가 충분하지 않은 경우 10 mg을 최고 3개월 이상 복용한 환자에서 23 mg을 처방해 볼 수 있다[8]. 취침 전 복용이 원칙이지만 꿈을 많이 꾸는 경우 아침 복용으로 처방할 수 있다. 주로 위장장애의 부작용이 흔하여 20-30%의 환자에서 오심, 구토, 설사 등 위장장애가 나타날 수 있으며, 위산 분비가 많아지고, 콧물이나 침 등 분비물이 많아지는 콜린성 부작용을 보이기도 한다. 부작용이 심한 경우 절반 용량인 2.5 mg으로 시작하여 서서히 증량할 수도 있으며, 2023년부터는 국내 제약사에서 3 mg의 제형을 생산하고 있어 이 제형을 이용해볼 수도 있다.
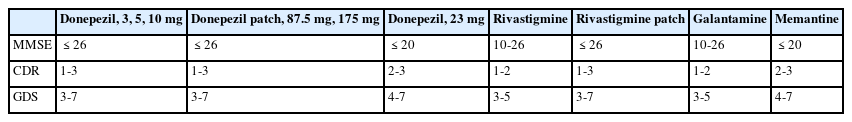
또한 2021년부터는 일주일에 2번 적용하는 패치가 국내 승인되어 사용 중이며 87.5 mg, 175 mg 두 가지 용량이 있다. 경구제와 비교하여 비열등성이 증명되어[9] 승인되었으며, 경구용 약제 투여가 어려운 사람에게 처방해 볼 수 있다. 패치 87.5 mg은 경구제 5 mg에 해당하고 패치 175 mg는 경구제 10 mg에 해당한다. 대개 부작용은 일시적이나 일부 환자에서 심장 전도 장애 및 서맥 등의 부정맥을 일으킬 수 있어 투약 전후 심전도검사를 권고하고 있다. 간기능, 신장기능에 따른 용량 조절은 필요하지 않으나, 85세 이상의 저체중 여성환자의 경우 경구제 용량 5 mg을 초과하여 처방하지 않도록 제한되어 있다. 국내에서는 아리셉트 경구제 3 mg, 5 mg, 10 mg 및 패치 87.5 mg, 175 mg의 경우 간이정신상태검사(mini-mental state examination, MMSE) 26점 이하이고, 임상치매척도(clinical dementia rating, CDR) 1-3점 혹은 전반적 퇴화척도(global deterioration scale, GDS) 3-7점의 환자에게 처방할 수 있으며, 23 mg 경구제의 경우 MMSE 20점 이하이면서 CDR 2-3점 혹은 GDS 4-7점인 환자에게 처방할 수 있다. 6-12개월 간격으로 재평가하여 계속 투여 여부를 결정하며, 재평가에서 MMSE의 경우 26점 또는 20점을 초과하여도 지속 투여를 인정한다. 다만 MMSE 10점 미만이고, CDR 3점 혹은 GDS 6-7점인 중증 치매의 경우 MMSE는 6-36개월 간격으로 재평가할 수 있으며, 장기요양등급 1등급인 경우 장기요양인정 유효기간까지 재평가 없이 계속 투여 여부를 결정할 수 있다(고시 제2023-165호).
(2) 리바스티그민
리바스티그민은 2000년에 FDA 승인을 받은 약제로 콜린분해효소뿐 아니라 부티릴콜린분해효소(butyrylcholinesterase)도 동시에 억제한다. 부티릴콜린분해효소는 주로 교세포(glial cell)에 위치하여 아세틸콜린을 조절하는 효과가 있다[10]. 부티릴콜린분해효소와 콜린분해효소를 동시에 억제하는 것이 알츠하이머병의 인지기능 유지에 도움이 되며, 특히 파킨슨병 치매에서도 효과가 있다[11]. 하루 3 mg으로 시작하여 최소 4주 투여 후 부작용이 없으면 증량해 볼 수 있으며, 부작용을 고려하여 하루 12 mg까지 증량하여 복용하는 데 반감기가 짧아 하루 2회 복용한다. 경구제뿐 아니라 경피형 패치도 있는데 패치는 4.6 mg, 9.5 mg, 13.3 mg의 3가지 용량이 있다. 경구 투여량으로 하루 6 mg 미만을 투약 받는 환자는 패치 4.6 mg으로, 하루 6-12 mg의 용량을 투약 받는 환자는 패치 9.5 mg으로 대체할 수 있다[12]. 패치 13.3 mg은 그보다 더 높은 용량으로 9.5 mg 패치를 6개월 이상 사용하였고, 좋은 내약성을 보인 경우 13.3 mg으로 증량할 수 있다. 패치 13.3 mg을 사용한 48주 임상시험에서 패치 9.5 mg과 비교하였을 때 더 높은 효용성을 보이는 것으로 나타났다[13]. 경구제는 소화기계 부작용이 도네페질보다 더 많은 것으로 알려져 있어 소화기계 부작용을 줄이기 위해서는 음식과 함께 복용하기도 한다. 패치는 소화기계 부작용이 적어 소화기계 부작용이 심한 사람에게 특히 도움이 된다[12]. 패치는 등, 팔의 상부, 가슴 등에 부착하도록 하고 24시간마다 교체하여야 한다. 이 때 같은 자리에 다시 붙이지 않도록 하고 한 번 붙인 자리는 2주 동안은 피하는 것이 좋다. 국내에서는 패치의 부작용이 11.7%에서 일어나는 것으로 보고되었으며, 주로 피부 문제와 소화기계 부작용이었다[14]. 패치 부착 부위에 홍반, 가려움이 나타날 수 있으며, 증상이 심하면 약한 스테로이드 연고를 적용해 볼 수 있으나 피부 증상이 그래도 심한 경우는 패치의 중단을 고려해야 한다. 신장기능과 간기능에 따라 약제 조절을 할 필요는 없으나, 약물 농도가 올라갈 수 있어 부작용을 경험할 가능성이 더 높으므로 면밀하게 관찰하면서 투여하도록 권장하고 있다. 중증 간 질환에서는 경구용과 패치 모두 사용에 대해서는 연구된 바가 없으나, 패치의 경우 경도(Child-Pugh score, 5-6)에서 중등도(Child-Pugh score, 7-9)로 간기능이 저하된 환자에서는 가장 낮은 용량의 패치를 사용해야 한다. 50 kg 미만의 저체중 환자도 낮은 용량의 약제 사용이 권장된다. 경구제는 MMSE 10-26점이고, CDR 1-2점 또는 GDS 3-5의 경우에 처방할 수 있으며, 패치는 MMSE 26점 이하, CDR 1-3점 또는 GDS stage 3-7에 해당하는 경우 처방할 수 있다. 경구제는 6-12개월 간격으로 재평가하여 계속 투여 여부를 결정하며, 재평가에서 MMSE 26점을 초과하여도 지속 투여를 인정한다. 패치의 경우 6-12개월 간격으로 재평가하여 계속 투여 여부를 결정하며 재평가에서 MMSE 26점을 초과하여도 지속 투여를 인정하는데, MMSE 10점 미만이고 CDR 3점 또는 GDS 6-7점인 중증 치매의 경우 6-36개월 간격으로 재평가할 수 있다. 장기요양 1등급인 경우 장기요양인정 유효기간까지 재평가 없이 계속 투여 여부를 결정할 수 있다. 파킨슨병의 치매에서 리바스티그민을 사용하는 경우 MMSE 10-26점, CDR 1-2 또는 GDS 3-5의 경증과 중등도 치매에서만 요양급여를 인정한다(고시 제2019-21호).
(3) 갈란타민
갈란타민은 2001년 FDA 승인을 받은 약제로 아세틸콜린 분해효소뿐 아니라 니코틴 수용체에 작용하여 아세틸콜린의 분해를 억제할 뿐 아니라 아세틸콜린의 분비를 촉진한다[15]. 갈란타민은 경구제만 존재하며 일일용량 8 mg으로 시작하여 4주 후에 16 mg으로 증량하며, 최대 하루 24 mg까지 사용할 수 있다. 반감기가 짧아 하루 2회로 나누어 처방하나 서방형 제제는 하루 한 번 복용도 가능하다. 다른 콜린분해효소 억제제와 마찬가지로 소화기계 부작용이 나타날 수 있어 소화기계 부작용이 있는 경우 식사와 함께 투약하고, 용량을 천천히 증량한다. 말기 신장병 환자나 간 질환이 있는 경우에는 혈중 약물 농도가 증가할 수 있으므로 사용을 주의해야 한다. 중등도의 간장애가 있는 경우 최소 일주일 동안 8 mg을 이틀에 한 번 투여하며 그 후 최소 4주일 동안은 8 mg을 1일 1회 투여하고, 1일 16 mg을 초과하여 투여하지는 않는 것이 좋다. 중증의 간장애(Child-Pugh score, >9) 환자에게는 투여하지 않는다. 신장 질환이 있는 경우 크레아티닌(creatinine) 청소율이 9 mL/min 이상인 환자에서는 용량 조절이 필요 없고, 그 미만 환자에게는 투여하지 않는 것이 좋다. 경증 및 중등도 치매에서만 보험 인정을 하기 때문에 MMSE 10-26점에 해당하고 CDR 1-2 또는 GDS 3-5에 해당하는 자만 보험 급여로 처방할 수 있다. 6-12개월 간격으로 재평가하여 계속 투여 여부를 결정하여야 하며, 재평가에서 MMSE가 26점을 초과하여도 지속 투여를 인정한다(고시 제2019-21호).
2) NMDA 수용체 대항제
N-methyl-D-aspartate (NMDA) 수용체 대항제는 글루타메이트(glutamate)의 흥분성 신경독성을 감소시켜 아세틸콜린의 작용을 효과적으로 하고자 하는 약물이다. 대뇌피질과 해마의 신경세포들의 주된 흥분성 신경전달물질인 글루타메이트는 학습과 기억 기능에 관여하는데, 이 글루타메이트는 NMDA 수용체를 활성화시킨다. 글루타메이트로 인한 NMDA 수용체의 활성화는 신경세포 간의 신호 전달과 기억 형성에 중요한 역할을 하는데, NMDA 수용체가 지속적으로 활성화되어 병적으로 과활성이 일어나게 되면 세포 내에 칼슘 농도를 증가시켜 신경세포가 손상을 입고 신경퇴행이 유발될 수 있다[16]. 따라서 단순히 NMDA 수용체를 억제하는 것만으로는 인지 저하에 좋은 효과를 가지고 올 수 없어 NMDA 수용체의 생리학적인 기능은 유지하면서 병적인 과활성만을 억제하는 것이 중요하다[17].
메만틴은 NMDA 수용체 대항 작용을 하는 약물 중에서 이런 기능을 잘 수행하는 유일한 약물로, 2003년 알츠하이머병 치료제로 FDA 승인을 받았으며, 글루타메이트 과활성으로 인한 NMDA 수용체의 활성화를 억제하여 인지기능 및 행동 정신 증상 개선에 효과가 있다[18]. 일일 5 mg 용량으로 시작하여 20 mg 용량까지 증량할 수 있다. 어지러움과 졸음의 부작용이 있을 수 있으며, 일부 환자에서는 초조의 증상을 보이는 경우도 있다[19]. 중증의 신장애 환자(크레아틴 청소율, 5-29 mL/min)에서는 하루 최대 용량을 10 mg 이하로 사용하여야 하며, 크레아틴 청소율 5 mL/min 미만의 경우는 투여하지 않도록 하고 있다. 경증 또는 중등도의 간장애 환자에서는 용량 조절이 필요하지 않으나, 중증의 간장애 환자에 대해서는 연구된 바가 없어 되도록 투여하지 않도록 권고하고 있다. MMSE 검사 20점 이하이고, CDR 2-3점 또는 GDS 4-7에 해당하는 환자에서 요양 급여로 처방할 수 있다. 6-12개월 간격으로 재평가하여 계속 투여 여부를 결정하여야 하나 MMSE 10점 미만이고 CDR 3 또는 GDS 6-7점인 중증 치매의 경우에는 6-36개월 간격으로 재평가할 수 있다. 장기요양 등급 1등급의 경우에는 장기요양 인정 유효기간까지 재평가 없이 계속 투여 여부를 결정할 수 있다. 메만틴과 콜린분해효소 억제제를 함께 사용할 경우 각 약제의 급여 기준에 적합하면 요양급여를 인정한다(고시 제 2017-109호). 약제의 보험 기준에 대해서는 Table 1에 정리하였다[19].
2. 아밀로이드 연쇄반응 가설 기반 치료제
알츠하이머병 치매의 발병은 아밀로이드 베타의 뇌 축적과 그에 따른 신경세포 시냅스의 소실로 신경퇴행이 일어난다는 가설이다. 신경세포의 세포막을 구성하는 아밀로이드전구단백질(amyloid precursor protein)이 절단 효소(secretase)에 의해서 분해가 되는데, 일부 베타 절단 효소에 의해 잘린 아밀로이드전구단백질은 분해되지 않는 아밀로이드 베타 펩타이드를 형성한다. 아밀로이드 베타 펩타이드는 응집하여 올리고머(oligomer)를 형성하는데, 올리고머는 그 자체로 독성을 보이기도 하고 서로 응집하여 프로토피브릴(protofibril)을 형성하고 더 응집하여 피브릴(fibril)을 형성한 다음 아밀로이드 판(plaque) 형태로 응집되어 독성을 나타낸다. 아밀로이드 베타가 뇌에 침착 되면 신경세포 시냅스의 소실이 나타나고, 타우 단백질의 침착을 유도하여 신경세포 소실을 가져와 신경퇴행을 일으킨다[20].
이 가설을 기반으로 아밀로이드 베타가 생성되는 것을 억제하거나 생성된 아밀로이드 베타를 제거하여 연쇄반응이 일어나지 않도록 하여 병의 진행을 억제하거나 지연시키고자 하는 약물이 개발되어 왔다. 그동안 대부분의 아밀로이드 연쇄반응 가설에 기반한 약제들이 임상시험에서 실패하였으나 2021년 아두카누맙(aducanumab)의 FDA 승인을 시작으로 2023년 레카네맙의 승인이 이루어져 아밀로이드 연쇄반응 가설에 기반한 약물에 기대가 증가하고 있는 상황이다. 아직 국내에서는 처방이 이루어지지 않고 있지만 FDA 승인을 받은 레카네맙과 2023년 임상시험 결과를 발표한 도나네맙(donanemab)에 대한 소개를 하고자 한다.
아밀로이드 연쇄반응 가설 기반 치료제는 아밀로이드 베타를 표적으로 하는 면역치료제이다. 면역치료에는 항원을 주입하여 항체 반응을 유도하는 능동면역이 있고, 항체를 반복적으로 주입하는 수동면역이 있다. 능동면역은 몇 번의 항원 주입만으로 고농도의 항체를 유발할 수 있으나, 노인에서는 항체 반응이 충분히 유도되지 않을 수 있으며, 항체로 인해 부작용이 생기면 항체가 체내에 남아있는 한 부작용이 지속될 수 있다는 단점이 있다[21]. 실제 능동면역 방법으로 약제를 개발하여 임상시험이 몇 차례 이루어졌으나, 무균성 뇌수막염이 발생하여 중단되기도 하였고[22], 충분한 임상 개선 효과가 나타나지 않아 현재는 거의 약제 개발이 되지 않고 있다[21]. 수동면역은 항체를 반복 투여해야 하기 때문에 번거롭고, 비용이 많이 들지만, 단일 클론항체가 외부에서 주입되기 때문에 항체가 제거되면 부작용도 제거되어 안전성 측면에서 더 선호된다[21]. 현재 승인을 받은 약제와 임상시험 결과가 발표된 약제는 모두 수동면역을 이용한 치료제이다. 하지만 수동면역을 이용한 약제에서도 아밀로이드를 제거하는 과정에서 혈액 뇌 장벽(blood-brain barrier)의 손상으로 인해 아밀로이드 관련 영상이상(amyloidrelated imaging abnormalities, ARIA)이 나타난다[23]. 주로 부종과 출혈을 일으키며, 그 중에서도 부종은 혈관 부종(vasogenic edema)이 나타나는데, 뇌 모세혈관 내피세포의 혈청 단백질에 대한 투과성(permeability)이 증가하여 세포외액(extracellular fluid)량이 증가하여 나타나게 된다. 대부분 무증상이나 일부에서 일시적인 두통, 혼동, 시각 이상을 경험하였었고, 보행장애를 경험한 사람도 있었다. 고농도의 약물 투여가 위험성을 높이는 것으로 알려져 있고, 아포지질단백(apolipoprotein E) e4 대립유전자(allele)가 부종 위험을 증가시키는 것으로 알려져 있다. 출혈은 대개 미세 출혈(microhemorrhage)과 표재성 철증(superficial siderosis) 형태로 나타나는데, 투과성 증가로 헴(heme) 생성물이 누출되어 나타난다. 고혈압, 소혈관 질환과 뇌 아밀로이드 혈관병증(cerebral amyloid angiopathy)이 관련이 있는 것으로 알려져 있다. 면역치료 도중 심한 고혈압과 신경학적 증상을 동반한 ARIA가 발생하여 치료한 보고가 있으며, 이 보고에서는 증상 발생 초기에는 혈압 치료만 하였으나 증상이 한달 뒤에 악화되어 레베티라세탐(levetiracetam)과 메틸프레드니솔론(methylprednisolone) 1,000 mg을 5일 정맥 주사하였고, 이후 증상이 호전되어 6개월 뒤에는 회복되었음을 보고하였다[24].
1) 레카네맙
레카네맙은 면역글로불린 G1 단클론항체로, 아밀로이드 베타 프로토피브릴과 올리고머에 친화력이 매우 높고 Fc 수용체 매개 포식 작용을 통해 아밀로이드 베타를 제거하는 아밀로이드 연쇄반응 가설 기반 면역치료제이다[25,26]. 정맥 주사제로 2주 간격으로 10 mg/kg 용량을 투여하는 것으로 임상시험을 진행한 결과를 정리하면 다음과 같다. 대상자는 50-90세 알츠하이머병으로 인한 경도인지장애환자 및 경도 알츠하이머병 치매 환자로 아밀로이드 양전자 방출 영상(positive emission topography, PET)이나 뇌척수액 아밀로이드 베타 42 검사에서 양성이 나온 사람이며, 웩슬러 기억력 척도 IV- 논리적 기억(logical memory) II에서 나이에 맞춘 평균보다 적어도 1 표준편차 이하로 낮은 기억력을 보이는, 객관적으로 삽화기억에 장애가 있는 사람을 대상으로 하였는데 참여자들의 MMSE 점수는 22-30점의 범주에 있었다. 18개월 동안 임상시험을 시행한 결과, 레카네맙은 임상 치매평가 척도 총합(CDR-sum of boxes, CDR-SB)을 이용하여 시행한 평가에서 위약 대비 기능 질병 진행을 27% 지연시키는 것으로 나타났다. 하지만 레카네맙은 전체 환자의 26.4%에서 주입 관련 부작용이 나타났고, 12.6%에서 ARIA-E, 17.3%에서 ARIA-H가 나타났다[27].
2) 도나네맙
도나네맙은 면역글로불린 G1 단클론항체로 아밀로이드 베타의 N 말단 절단형태(truncated form)에 결합하여 미세아교세포 매개 포식작용을 통해 아밀로이드 판을 제거하는 아밀로이드 연쇄반응 가설 기반 면역치료제이다[28]. 60-85세 알츠하이머병으로 인한 경도인지장애 환자 및 경도 알츠하이머병 치매 환자로 MMSE는 20-28점에 해당하고 아밀로이드 PET에서 아밀로이드 침착을 보이고 타우 PET에서도 타우 침착을 보이는 환자를 대상으로 임상시험을 시행한 결과는 다음과 같다. 정맥 주사제로 4주마다 52주 동안 약제를 투여하는데, 첫 3번은 700 mg을 투여하고, 나머지 기간은 1,400 mg을 투여하였다. 인지기능과 일상생활 유지기능을 동시에 반영하는 지표인 통합 알츠하이머병 질환평가척도(integrated Alzheimer’s disease rating scale)를 이용하여 평가하였으며, 위약 대비 질병 진행을 22.3% 지연시키는 것으로 나타났다. CDR-SB를 이용하여 시행한 평가에서는 위약 대비 질병 진행을 28.9% 지연시키는 것으로 나타났다. 8.7%에서 주입 관련 부작용이 나타났고, 24%에서 ARIA-E가 나타났고, 31.4%에서 ARIA-H가 나타났다[29].
결론
알츠하이머병은 아직까지도 그 치료법이 명확하지 않은 질병이나, 2023년 약 20년만에 기존과는 전혀 다른 기전의 약제가 FDA 승인을 받으면서 치료법에 대한 관심이 증가한 상태이다. 특히 아밀로이드 연쇄반응 가설을 기반으로 한 면역치료제의 적용으로 병의 진행을 근본적으로 멈추거나 지연시킬 수 있을 것이란 기대가 있다. 하지만 아직 국내 도입이 되지 않아 국내 환자에서의 효용성과 부작용에 대한 자료는 거의 없는 상태이다. 안전한 약물 사용을 위해서 외국 임상시험 자료를 기반으로 국내 환자에서 예상되는 부작용을 잘 숙지하고 부작용을 모니터링할 방법 및 부작용이 발생하였을 때 대처해야 할 방법에 대해서 체계적으로 대비하는 것이 필요하다.
Notes
Conflict of Interest
No potential conflict of interest relevant to this article was reported.
References
Peer Reviewers’ Commentary
이 논문은 알츠하이머병의 약물치료에 대해 기존의 약물뿐만 아니라 새로 개발된 면역 치료제에 대해 최신 문헌을 토대로 체계적으로 정리하여 소개하고 있다. 현재 사용이 가능한 약의 작용기전을 쉽게 이해할 수 있게 잘 설명하고 있으며, 처방 용법, 처방시 주의사항, 급여 관련 평가 등을 상세히 다루어 약물을 처방하고자 하는 의사들에게 실질적인 도움을 줄 것이다. 새로 개발된 알츠하이머병 항체 치료제의 특성에 대한 정보도 이해하기 쉽게 설명해 주고 있으며, 대상자의 특성 및 약물의 처방 용법 및 효용성을 제시하고 있다. 또한 아밀로이드 관련 영상 이상에 대해서도 상세히 다루고 있어 향후 약물의 국내 도입을 대비하는 데 도움이 될 것이다. 이 논문은 임상 현장에서 경도인지장애 및 치매 환자를 진단하고 치료하는 데 실질적인 도움이 되는 좋은 지침이 될 것으로 판단된다.
[정리: 편집위원회]