장기 위암 경험자의 관리
Management of long-term gastric cancer survivors in Korea
Article information
Abstract
The incidence of gastric cancer is high, and gastric cancer has one of the highest survival rates of any type of cancer in Korea. With increased long-term survival in a growing number of patients, more patients suffer from health problems such as treatment-related symptoms, malnutrition, chronic diseases, anxiety, and depression. Gastric cancer survivors also have a higher risk of developing a second primary cancer and recurrence. Therefore, survivorship care guidelines for gastric cancer survivors that address surveillance for recurrence, screening for second primary cancers, assessment and management of physical and psychosocial long-term effects of cancer and its treatment, health promotion, and care coordination are needed. The role of primary care physicians is essential for providing continuous care to gastric cancer survivors and their family.
서론
암의 조기발견과 암 치료의 발전에 따라 암 경험자의 수가 빠르게 증가하고 있다. 2015년 발표된 중앙암등록본부 암 통계에 따르면 암 진단 후 현재까지 생존해 있는 환자는 137만 명이 넘어서고 있으며, 5년을 초과하여 생존한 암 경험자의 수도 58만 5,000명에 달하고 있다[1]. 장기 생존한 암 경험자들이 증가하면서, 암 치료를 시행하는 암 전문의료기관 뿐 아니라 지역사회의 일차의료기관에서도 암 경험자들을 보는 것이 점점 흔해지고 있다. 특히 위암은 우리나라에서 전통적으로 흔했던 암으로, 암 치료 후 5년 이상 경과한 암 경험자의 수는 2013년 말 현재 11만 명으로 모든 암 중 가장 많은 수를 차지하고 있다[1].
암 경험자는 원발암에 대한 추적관리뿐 아니라, 이차암에 대한 예방 및 검진, 후기 합병증 및 암 이외의 동반 만성질환에 대한 관리, 예방접종, 생활습관, 심리사회적 문제에 대한 포괄적인 관리가 필요하다. 본고에서는 일차의료기관에서 보게 될 수 있는 위암 치료 후 장기간 경과한 위암 경험자의 흔한 건강문제와 이에 대한 관리방안을 다루고자 한다.
위암 치료의 이해
위암은 우리나라에서 가장 발생률이 높은 암 중의 하나이며, 국내 남성에서는 암 발생률 1위, 여성에서는 암 발생률 4위를 차지한다[1]. 위암의 5년 상대 생존율은 남자의 경우 73.9%, 여자의 경우 71.%이다[1].
진행된 위암은 예후가 나쁘지만, 우리나라의 경우, 위암에 대한 국가 암검진 체계가 잘 구축되어 있어 조기위암이 전체 위암 환자의 50% 이상을 차지하고 있다[2]. 조기위암은 림프절 전이 여부에 관계없이 위의 점막층 및 점막하층에 국한된 위암으로 정의되는데 검진을 통하여 조기위암 단계에서 발견하면 예후가 대단히 좋다. 이들 조기위암 환자에서 표준수술방법인 개복 위절제술을 시행하는 경우 95% 이상의 우수한 5년 생존율을 보인다[3].
근치적 위암 수술 시 전형적인 위절제 범위는 병변의 위치에 따라 중하부 위암의 경우에는 2/3 이상을 절제하는 위아전절제술 또는 상부 위암의 경우 전체를 절제하는 위전절제술이다. 이와 더불어 위 주위 림프절뿐 아니라 총간동맥, 좌위동맥, 복강동맥, 비장동맥 주변 림프절 등을 포함하는 D2 림프절절제술을 표준 수술요법으로 시행한다[4].
2기 이상은 재발률이 28.6%에 달해 수술 후 보조항암요법이 필수적인 표준치료로서 정립되어 있으며, 경구용 항암제인 S1을 1년간 사용하거나 capecitabine/oxaliplatin을 6개월간 병행하는 것이 일반적인 치료이다. Ib기(N1)에서의 재발률은 3.7% 정도이나 우리나라에서는 보조항암요법을 시행하는 경우가 많다[5]. HER2 양성 전이성 위암의 경우 trastuzumab을 사용하기도 한다[6].
표준적인 위절제술 후 식이불편 및 장기적인 영양상태 불량 등의 문제점을 줄이고자 위절제의 범위를 축소함으로써 기능을 최대한 보존하고자 하는 시도가 있다. 조기위암이 체부 중간 부분에 있을 경우 유문보존 위절제술, 위 상부에 위치하는 경우 근위부위절제술, 위의 한 부분만 절제하는 위 구역 절제술 등이 시도되고 있으나, 재발 및 생존율, 기능 개선에 대한 효과에 대해서는 아직 논란의 여지가 있다[3].
최근에는 복강경을 이용한 위절제술, 로봇을 이용한 위절제수술과 같이 복벽에 만들어지는 창상은 다르나, 복강 내에서 진행되는 위절제 범위 및 위 주위 림프절절제와 같은 술식은 차이가 없는 최소침습수술의 사용이 늘어나고 있는 상황이다[3].
림프절 전이가 없을 것으로 예상되는 분화암에 대해서는 내시경을 이용한 내시경 절제술의 시행이 늘어나고 있다. 내시경 점막 절제술은 IIa형인 경우 병변의 크기가 2 cm 이하, IIc형인 경우 궤양이 없으면서 병변의 크기가 1 cm 이하인 경우가 일반적인 적응증이었으나, 내시경 점막하 절제술이 시행되면서 2 cm 이상의 병변은 물론, 궤양 반흔이 있는 병변에서도 기술적으로 일괄절제가 가능하게 되어 내시경 치료의 적응증이 확대되고 있다. 최근에 일반적으로 받아들여 지는 확대 적응증은 1) 림프-혈관계 침범이 없는 궤양이 없는 분화형 점막암인 경우 병변 크기에 관계없음, 2) 림프-혈관계 침범이 없는 궤양을 동반하는 분화형 점막암인 경우 병변 크기 3 cm 이하, 3) 림프-혈관계 침범이 없는 분화형암이면서 점막하층 침범이 500 µm인 경우 병변 크기 3 cm 이하, 4) 림프-혈관계 침범이 없는 미분화형 점막암인 경우 병변 크기 2 cm 이하인 경우이다[7].
위암 경험자의 원발암에 대한 추적관찰
위암의 근치적 절제술 후 재발은 주로 림프절, 간, 복막의 순서로 나타난다. 조기위암의 절제 후 재발률은 1-2% 정도로 보고되고 있는데 점막하 암이 점막암에 비해(2.2-3.6% 대 0.4-0.7%) 재발 가능성이 높았으며, 림프절 전이가 있는 경우 림프절 전이가 없는 경우에 비해(7.2-10.7% 대 0.6-1.1%) 재발 가능성이 높았으나 종양의 크기나 위치 등은 재발과 연관이 없었다[89]. 특이한 점은 진행성 위암과는 달리 조기위암에서는 분화가 좋은 암이 잘 재발한다는 점으로 (1.7-2.3% 대 1.1-1.3%), 분화가 좋은 암의 혈행성 전이가 많기 때문으로 생각된다[5].
위암 재발 발견을 위한 추적관리 프로그램이 생존증가에 기여하는지에 대해서는 부정적인 연구 결과가 존재하나[10] 가능한 한 조기에 재발을 발견하여 증상을 완화하고 생존율 을 향상시키기 위한 추적관리의 필요성은 대부분의 의사들이 동의하고 있다[5]. 대한위암학회 회원을 대상으로 한 위암 환자의 수술 후 추적관리 현황에 대한 설문 결과에 따르면, 우리나라 외과의사들은 수술 후 5년 동안 4-6개월 간격으로 원발암의 재발 및 전이에 대해 추적관찰을 하는 경우가 가장 많았으나, 3년까지만 추적 관찰하는 경우부터 평생 추적 관찰하는 경우까지 다양하였다. 추적관찰 방법은 조기위암의 경우 보통 위내시경(94.3%), 복부전산화단층촬영 (86.2%), carcinoembryonic antigen, CA-19-9 등의 종양표지자(72.4%) 등으로 시행하였고, 일반혈액검사, 간 기능검사, 흉부촬영 등은 40-50% 정도에서 사용되었다[11].
통상적으로 완치 판정으로 받아들여지는 5년 이후에 위암 수술 후 장기 생존자들에 대해 언제까지 어떠한 방법으로 해야 하는지에 대한 근거는 현재 거의 없는 현황이다[5]. 하지만 조기위암의 재발은 그 발현 시점이 다소 늦은 경향을 보인다고 보고되는데, 3년 이후 재발한 환자가 전체의 28.6-55%, 5년 이후에 재발한 경우도 23%에 이르는 것을 나타나는 점을 고려해야 할 것으로 보인다[89].
조기위암의 내시경 점막 절제술을 시행한 후 국소 재발률은 약 2년간 관찰 시 약 6% 정도로 보고되었으나[12], 최근 내시경 점막하박리술로 완전절제 후 국소재발률은 약 4년간 관찰 시 1% 미만으로 보고되고 있으며 림프절 전이는 매우 드문 것(0.15%)으로 알려져 있다[13]. 따라서 5년이 지난 후에는 1년에 1회 정도 위내시경을 받는 정도로 추적 관찰하면 될 것으로 생각된다.
위암 경험자의 이차암에 대한 예방과 검진
1. 잔위의 이차 위암
위부분절제술 후 잔여 위에도 위암이 생길 가능성은 상당히 잔존하는 것으로 알려져 있다. 일본의 한 연구에 따르면 5년 추적관찰 기간 동안 2.4%, 10년 추적관찰 기간 동안 약 6.1% 정도로 보고되고 있다[14]. 이는 적어도 일반인과 같은 수준이거나 더 높을 것으로 추정된다[5]. 잔위암의 경우에는 근치적 절제가 되지 않는 경우가 30% 정도로 비교적 높게 보고되어 있으나, 주기적으로 내시경을 시행한 그룹에서는 잔위암이 조기 진단되는 경우가 많고[15], 조기 진단된 경우 절제율과 생존율이 증가될 수 있으므로 1년에 1회 정도는 위내시경을 시행하는 것이 바람직할 것으로 생각된다[5].
수술 후 잔위암을 예방하기 위하여 헬리코박터균의 제균이 필요한지에 대해서는 아직 이견이 있다. 일반적인 위아전절제술 후에는 위산이 거의 분비되지 않기 때문에 헬리코박터가 자연 소멸되는 경우가 많으나, 유문보존위절제술의 경우에는 위산 분비가 유지되어 헬리코박터균이 발견되는 비율이 높다고 보고되었다[5]. 내시경적 절제술 후에는 잔위암의 발생률이 매우 높기 때문에 헬리코박터 제균요법의 적응증이 되며[16], 잔위의 위암 발생률을 약 1/3정도로 줄일 수 있음이 무작위배정임상시험을 통해 증명되어 있고[17] 국내에서의 비용 효과성도 증명되어 있다[18].
2. 다른 부위의 이차암
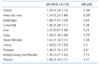
위암 경험자에서 이차암에 대한 상대 발생위험도는 각 연구마다 다르다(Tables 1, 2) [1920]. 우리나라와 역학적 특성이 비슷한 일본의 인구기반집단의 자료인 오사카암등록자료 연구에 따르면[19] 대장암의 경우 1.40배, 폐암 1.26배, 유방암 1.63배, 전립선암 1.36배 등으로 전반적으로 약간 높은 이차암 발생 위험도를 보여주었다.
조기 위암은 예후가 좋은 편이기 때문에 위암이 아닌 이차암이 직접적인 사망의 원인이 될 가능성이 높다. 예를 들면 흡연자였던 조기위암환자의 경우 치료 후 폐암이 발생한다면 폐암이 직접적인 사망원인이 될 가능성이 크다. 위암 경험자도 적어도 일반인구집단에 권고 되는 수준의 암 검진은 기본으로 받아야 하며[21], 다른 암에 대한 가족력 여부, 흡연이나 비만 등의 위험 요인 여부 등을 고려하여 검진 계획을 세우는 것이 필요하다.
서울의 한 대학병원의 위암 경험자 클리닉을 방문한 환자들에 대한 조사에서 위암 수술 후 3년 이상 경과한 위암 경험자의 연령과 성별에 적합한 이차암 검진율은 대장암 76.3%, 유방암 71.6%, 자궁경부암 34.2%, 폐암 13.6%의 순으로 나타났다[22]. 이는 국내에서는 오직 37.5% 정도의 암 경험자만이 연령 및 성별에 적합한 이차암에 대한 검진을 받고 있다는 선행연구 결과와 일치하는데[23]. 암 경험자들의 상당수가 '이차암에 대한 검진'과 '원발암 재발이나 전이에 대한 정기 추적관찰'의 개념을 구분하지 못하여, 컴퓨터단층촬영 검사나 혈액 검사만으로 이차암 검진까지 모두 커버되는 것으로 잘못 알고 있는 것과도 연관되어 보인다[2324]. 따라서 지역사회의 일차의료로 복귀 후 일차의료인들이 필수 암검진을 챙겨주는 것이 꼭 필요하다고 생각된다.
위암 경험자의 후기합병증 관리
근치적 위 절제술은 위암치료를 위해서 꼭 필요한 것이지만, 위의 저장 기능 및 유문괄약근 기능이 소실되고, 미주신경 절단이나 소화기관 재건에 의한 생리적 변화가 일어나기 때문에, 다양한 장애와 증상이 나타나는데 이를 통틀어 위절제후증후군이라 한다[25]. 식이를 조절하거나 시간이 경과하면 다수에서 호전되지만, 장기간 회복되지 않고 삶의 질이 심각하게 저하되는 경우도 있어 적절한 지지적 치료가 중요하다.
1. 덤핑증후군
덤핑증후군(dumping syndrome)은 위의 저장 용량이 작아지고 위의 유문부가 절제됨으로 인해 당도가 높은 음식물이 소장으로 급격히 유입됨으로써 발생한다. 혈장의 변화와 호르몬의 분비로 식후 30분 정도에 빈맥, 설사, 오심이 발생하는 조기 덤핑증후군과, 급격히 올라간 혈당을 교정하려는 과정에서 인슐린 과분비로 인해 식후 2-3시간에 오히려 발한, 현기증 등의 반응성 저혈당 증상이 발생하는 후기 덤핑증후군이 있다.
덤핑증후군이 심한 경우 심리적 위축으로 삶의 질이 떨어지고, 식사자체를 피하여 영양 문제를 야기하기도 하기 때문에 철저한 식사교육이 중요하다. 덤핑증후군을 예방하기 위해서는 식사를 조금씩 자주 하도록 하고, 단 음식을 줄이고 탄수화물 대신 단백질 함량을 높이고, 국물 섭취를 줄이고 음식을 물에 말아먹는 것을 피해야 한다. 저혈당 증상이 나타나면 혈당을 올리도록 주스, 꿀물, 사탕 등 단 음식을 소량 먹도록 하나 평상시에는 먹지 않도록 한다. 아직까지 정립된 약물치료는 없으며, 무작위배정 임상연구는 없으나 후기 덤핑증후군의 경우 탄수화물의 흡수를 저해하는 당뇨 약제인 alpha-glucosidase inhibitor를 식전 30분 정도에 투여함으로써 인슐린 분비를 억제하고 증상을 호전시킬 수 있다는 보고들이 일부 있다[26].
2. 위산 및 담즙의 역류
위아전절제 시에는 위산이 식도로 역류하여 흉통, 신물, 목에 걸리는 느낌 등의 증상을 초래한다. 위 용적의 감소와 위운동성의 저하, 식도 하부의 괄약근의 기능저하 등의 요인이 역류를 조장한다. 예방에 가장 중요한 것은 과식을 줄이고, 식사 후 눕지 않는 것이다. 특히 저녁식사는 취침 전 4시간 이전에 하고 하루 중 가장 적게 먹도록 하는 것이 좋다. 잘 때는 베개 두 개를 사용하여 등부터 상체를 약간 높게 만들어 주는 것도 도움이 될 수 있다. 약물로서는 프로톤 펌프 억제제를 사용한다.
Billroth I 또는 II 문합 후에는 유문부의 소실로 인하여 답즙이 역류하여 상복부통, 구역, 담즙성 구토를 호소할 수 있으며, 수면 중에 담즙이 역류해 잠이 깨는 경우도 흔하다. 내시경검사를 해보면 답즙 역류성 위염이 관찰되는 경우가 많으나, 증상과 검사소견이 반드시 일치하지는 않는다, 위산분비 억제제, 항콜린 약물, cholestyramine 등을 투여하기도 하지만 효과가 뚜렷하지는 않으며, 증상이 아주 심하다면 수술적으로 교정해야 한다.
Foipan (camostat mesilate)은 단백분해효소의 일탈에 의한 만성췌장염의 급성증상 완화의 목적으로 사용되는 약으로 식도에서 역류한 위액 중 췌장 분비물 중의 하나인 trypsin을 억제하는 기전에 의해 위 절제 수술 후 발생하는 역류성 식도염의 증상 호전에 도움이 된다[27]. 이러한 경우 만성췌장염에 투여하는 용량의 절반인 100 mg을 3회 투여한다. 부작용은 드문 편이나 발진, 가려움 등의 과민증상, 식욕부진, 구역, 구갈, 복통, 간수치 이상, blood urea nitrogen, creatinine 상승, 혈소판 감소 등이 있을 수 있다.
근위부위절제술이 시행된 경우에는 역류성 식도염이 매우 흔하여, 지속적으로 프로톤 펌프 억제제를 사용하여야 하는 경우가 많다. 유문보존 위절제술은 담즙 역류에 의한 위염이 적은 편이다.
3. 위 마비
위 정체, 위 배출 지연으로도 불리며, 미주신경 절제로 인해 위의 배출능력이 약화되는 것이 원인이다. 약 50%의 환자에게서 발생하며 상복부 팽만감이 주요 증상이다. 많은 경우 시간이 경과하면서 완화되지만, 드물게 기능적인 위 출구 폐쇄로 발전하기도 한다. 진단은 위십이지장 내시경검사 또는 바륨이나 신티그래피 조영제를 이용한 위 배출검사를 시행한다. 일반적인 금식 기간 후에도 내시경상 잔여 음식물이 남아있는 경우가 흔하다. 구조적 폐쇄가 아니라면 위 운동 촉진제를 사용하는 것이 도움이 된다.
4. 설사
미주신경 절단 후 약 5-10%의 환자에서 나타나지며, 대다수의 경우 수술 후 몇 개월 안에 증상이 완화된다. 원인으로는 미주신경 차단에 따른 장운동 장애, 담즙산의 흡수 장애, 덤핑증후군으로 인한 빠른 위 배출, 장내 세균의 과잉성장을 들 수 있다. 전체 1% 미만의 환자에서는 오랜 기간이 지나도 설사가 지속될 수 있는데, 설사를 유발하는 음 식을 피하도록 하고, 약제로서는 cholestyramine, codeine, loperimide 등을 사용해볼 수 있다. 위산분비 과다가 원인인 경우도 있으므로 위산분비 억제제를 시험적으로 처방해 볼 수도 있다[25].
5. 담석증
위 절제 시 앞 미주신경 줄기의 간분지가 절제되는 경우 담낭의 운동장애가 초래되어 담석이 잘 발생할 수 있다. 위 절제술 전에 담석이 있는 경우에는 담낭을 보통 동반절제 하나, 예방적 담낭절제는 일반적이지 않다[25].
위암 경험자의 동반질환 관리
1. 골다공증
위암 경험자들의 경우 십이지장에서의 칼슘 흡수가 저하되고, 지방흡수 저하로 지용성 비타민인 비타민 D의 흡수가 저하된다. 이에 의해 이차적 부갑상선 항진증이 발생하여 골감소 속도가 증가하고 골다공증의 위험이 높아진다. 국내의 연구에서도 위암환자들은 높은 골다공증(약 40%)과 골감소증(약 30%)의 분율을 보였고 남자 환자들에게서도 골다공증 이 적지 않으나[28], 대부분의 위암 경험자들, 특히 골다공증 검진의 일반적인 대상이 되지 않는 남자 환자들의 경우 골다공증 검진을 받지 않고 있는 실정이다.
골밀도검사(이중에너지 X선 흡수계측법) 결과에 따라 골감소증이 있는 경우 칼슘과 비타민 D를 보충하고 체중부하운동을 권장한다[29]. 위산분비가 저하되어있는 경우가 많으므로 가급적 calcium citrate제제를 사용하는 것이 좋다. 골다공증이 있는 경우에는 bisphosphonate를 사용한다[30].
2. 심뇌혈관질환
위암 수술 후에 임상적으로 많은 환자들을 체중이 감소됨과 함께 임상적으로 혈압, 당뇨, 콜레스테롤의 호전을 보이는 경우가 많다. 이는 고도비만에 대한 위절제술과 같은 효과로 생각된다. 예를 들면 중국의 한 연구에서는 당뇨환자에서 위아전절제술 후 공복혈당, 2시간 식후혈당, 당화혈색소의 호전을 가져왔으며, 당뇨약을 끊거나 당뇨조절상태가 호전되는 것으로 나타나, 당뇨조절에도 효과적인 치료법일 수 있다는 보고를 한 바 있다[31]. 국내 연구에서 조기 위암으로 위 절제술을 받는 환자들은 대조군에 비해서 전체 사망률은 유사하였으나, 심혈관질환에 대한 사망률은 현저히 낮게 조사되었다(표준화 사망비=0.35)[32].
그러나 상당수의 환자들은 체중회복과 함께 고혈압, 당뇨, 고지혈증 등이 다시 악화되기도 한다. 이 경우 암 진단은 환자와 의사 모두 암 이외에 문제들로부터 관심을 멀어지게 하는 경우가 많아 적절한 관리가 필요하다[33]. 실제로 암병력이 있는 고혈압환자들이 일반 고혈압환자들에 비하여 약물의 순응도가 낮다거나[34], 암병력이 있는 당뇨환자들이 일반 당뇨환자들에 비하여 당뇨관리나 조절 정도가 떨어진다고 보고되기도 하였다[35].
위암 경험자의 건강생활습관 관리
흡연과 비만, 부적절한 영양 및 신체활동의 부족은 잘 알려진 암의 위험요인이며, 암 진단 후에도 지속되는 경우가 많은데, 이는 원발암의 경과, 이차암의 발생, 동반질환의 발생에 악영향을 주므로 이에 대한 관리가 중요하다. 특히 암 진단은 생활습관 개선에 대한 강력한 동기를 제공하므로, 이러한 'teachable moment'를 살려 생활습관에 대한 개입을 하는 것이 필요하다.
1. 금연 및 절주
흡연과 음주는 암과 다른 만성질환의 주요한 위험인자로 암 경험자에게 원발암의 예후, 이차암의 발생, 동반질환의 악화 등 다방면으로 악영향을 미친다. 일본에서 수행된 위암 경험자의 이차암 위험에 대한 장기 추적연구에서 흡연은 이차암의 위험을 1.82배 높였고, 과도한 음주는 이차암 위험을 2.66배 높였다. 또한 흡연은 전체 암 생존율뿐만 아니라 5년 생존율, 위암 특이 생존율을 낮추는 위험인자로 나타났다[36].
그러나 서울의 한 대학병원에 의뢰된 장기 위암 경험자에 대한 조사에 따르면, 조사 대상자 중 흡연자는 7.2%, 위험 음주자는 8.8%로 주로 남자 환자들이었다. 국내에서 조사된 다른 연구에서도 암 진단 전 흡연자 중 암 진단 후에도 흡연을 지속하거나 일시적으로 끊었다가 다시 피우고 있는 암 경험자가 1/4이나 되며[37] 의료진이나 가족들로부터의 비난 및 스스로의 죄책감 때문에 흡연사실을 숨기 경우도 많기 때문에[38], 일차의료에서 흡연과 음주 문제에 대한 적절한 스크리닝과 치료가 중요하다.
2. 체중 및 영양관리
1) 체중감소와 영양결핍
위절제수술 후 대부분의 환자는 식이섭취량이 감소하면서 수술 후 3-6개월 동안 체중이 최저치에 도달하여 평균 10-15% 정도 감소한다. 이후 식사량이 늘어나면서 수술 후 1년 정도가 되면 체중이 회복되는 경우도 많지만, 회복이 되지 않는 경우도 많다[25].
체중감소가 영양장애를 의미하는 것은 아니지만, 일부의 환자들은 장기간의 영양결핍의 가능성을 가진 채 살게 되는데, 영양상태를 평가하는 지표로는 신체계측평가(체중, 삼두박근 두께 등), 생화학적 평가(알부민, 콜레스테롤 등), 임 상증후평가, 영양섭취평가, 영양상태평가(subjective global assessment, mini-nutritional assessment) 등이 있으며 [2539], 이에 따른 상담과 교육이 필요하다.
보통 위절제술 후 발생하는 체중감소의 특징은 체지방의 선택적 감소로, 원래 과체중 또는 비만이었던 환자들의 경우에는 수술 전 체중이 아닌 건강한 체중으로 돌아갈 수 있도록 안내해야 한다[25].
2) 지방흡수 장애
위절제 수술 환자에서는 음식물과 췌장 소화액이 충분히 섞이지 않아 지방의 흡수저하가 발생할 수 있고 대변의 지방 함량이 증가한다. 췌장 효소 소화제를 사용하면 호전된다[40].
3) 빈혈
(1) 철결핍성 빈혈
위절제술 후 가장 흔한 빈혈은 철결핍성 빈혈로 30-50% 이상의 환자에서 발생하며, 위전절제 시에는 위아전절제술 후에 비해 더 흔하게 발생한다. 식이량 감소로 인한 섭취부족, 산분비 저하와 십이지장 우회로 인한 흡수 부족이 주요 원인이다. 치료로는 먼저 경구 철분제를 투여하며 식사 중에 음식과 함께 섭취하거나 비타민 C와 함께 복용하는 경우 철분의 흡수율을 높일 수 있다. 약 30%의 환자에서는 소화불량, 속쓰림, 메스꺼움, 변비 등의 부작용이 나타날 수 있다[40].
경구제 복용이 어려운 환자에서는 주사제를 사용할 수 있으며 ferric hydroxide sucrose 2,700 mg/5 mL (=Fe3+100 mg)의 경우 1회 1-2앰플씩 30분간에 걸쳐서 주 2-3회로 정주 사용이 가능하며, 가장 최근에 나온 ferric carboxy maltose 제제는 한번에 1,000 mg까지 투여가 가능하며 15분 이상에 걸쳐 정맥주사한다. 주사제 사용의 이상반응으로는 복통, 구역, 구토, 흉통, 두드러기, 소양감, 발열이 있고, 드물게 아나필락시스 반응이 있을 수 있다. 주사제 투여 후 일 주일 이내에 헤모글로빈의 상승효과를 기대할 수 있으며 적어도 3개월까지는 지속적인 헤모글로빈의의 상승을 보인다[40].
(2) 비타민 B12 결핍성 빈혈
위전절제술 환자에서는 내인자의 결핍으로 거대 적혈모구 빈혈이 발생한다. 위아전절제술 후에도 산성도의 감소는 장내 세균의 과증식을 유발하고 이로 말미암아 비타민 B12의 흡수장애가 발생할 수 있다. 혈청 비타민 B12가 200 pg/mL 이하인 경우가 위전절제 후의 경우 1년째, 2년째, 3년째 각각 42.9%, 63.6%, 77.8%였고 아전절제 후에는 각각 6.0%, 17.8%, 13.2%였고, 시간이 경과할수록 빈도가 증가한다. 비타민 B12 부족 시에는 백혈구나 혈소판 수치의 감소가 동반될 수 있고, 손저림과 같은 말초신경장애, 치매나 정신증도 발생할 수 있으며 신경장애의 경우 치료가 늦어질 경우 후유증이 남을 수 있다, 철결핍성 빈혈이 동반되면 혈액검사상 대적혈구가 나타나지 않을 수도 있고 빈혈보다 신경장애가 먼저 나타날 수 있으므로 정기적인 추적검사에 포함하여야 한다[40].
주사제로는 혈중 B12가 200 pg/mL 이하인 경우 cobamamide 1,000 mcg을 매달 근육주사하고 정상 수치가 되면 3-4개월 간격으로 주사해야 한다. 경구 투여로서는 cyanocobalamine 250 mc를 1회 2캡슐 하루 1-2회 투여하나, 흡수율이 낮으므로 주기적인 혈중 비타민 B12 검사를 진행하며 용량을 조절한다[40].
3. 운동과 신체활동
위암 경험자에게 있어 운동은 매우 중요하다. 운동은 위 수술 후 저하된 소화작용을 촉진할 뿐 아니라, 근력과 신체의 기능 유지에 도움이 되므로, 위암 경험자의 삶의 질 향상에 매우 중요하다. 따라서 위암 경험자는 역시 신체활동을 늘리고, 특별한 문제가 없다면 일반인에게 권장되는 수준의 운동 권고안을 따를 수 있도록 한다[4243].
4. 예방접종
암 경험자는 면역력이 저하되어 있기 때문에 일반인보다 철저한 예방접종이 필요하다. 암 경험자의 예방접종 시 접종량과 시기는 일반적인 성인 예방접종 권장안을 따르며, 일반적으로 면역이상이 없는 암 경험자에게 권장되는 백신은 인플루엔자, 폐렴사슬알균, 디프테리아-파상풍-백일해와 B형 간염이다. 그러나 상당수의 암 경험자가 단순히 몰라서 또는 막연한 두려움으로 인해 예방접종을 꺼리는 경향이 있으며, 의료진이 제대로 안내하지 못하는 경우도 있다[44].
위암 경험자의 정신사회적 문제에 대한 관리
우리나라에서 위암 수술 후 1년 이상 경과한 위암 경험자에 대한 연구에서 44%가 우울증을 가지고 있는 것으로 나타났다[45]. 외국의 연구에 의하면 위장관계 암 환자의 약 17%가 불안을, 21%가 우울을 경험하며, 위암 환자가 대장암 환자에 비해 진단으로 인한 정신적 스트레스에 더 취약한 것으로 나타났다[4647].
일상진료 중에 의사가 이러한 정신사회적 문제를 알아차리지 못하는 경우가 많으므로[48], 적극적인 선별검사를 통해 문제가 있는 환자들을 적절한 서비스로 연결시키는 것이 필요하다. 국립암센터의 '암환자의 삶의 질 향상을 위한 디스트레스 관리 권고안'에서는 디스트레스의 선별 및 평가, 평가에 따른 관리 흐름, 약물 및 비약물 치료에 대한 가이드를 제공하고 있다[49].
위암 경험자의 가족에 대한 관리
위암 가족력은 위암 위험도를 약 2-3배 높이며, 헬리코박터 감염이 동시에 있는 경우에는 상승효과가 있어 대조군에 비해 5-8배까지 높은 위암발생률이 보고되었다[5051]. 이와 같은 고위험군에서 현행 2년 주기보다 더 짧게 검진을 받아야 하는지에 대한 근거는 불충분하다.
위암 예방을 위하여 위암 환자의 형제나 자녀의 경우 헬리코박터 검사를 해보고 양성인 경우 치료를 하는 것이 일반적으로 권장되고 있으나, 직접적인 연구결과는 없는 상태이다[16]. 흡연은 위암의 위험을 올리므로 금연을 권유하고 및 금연 치료를 제해야 한다. 위암 예방을 위한 식이요인에 대한 근거는 불충분하나 현재까지의 근거로 볼 때 소금이나 염분이 높은 음식, 훈제나 가공육은 위암 발생위험을 높이고, 비전분채소, 파속 식물, 과일, 콩류 등은 위암 발생위험을 낮출 가능성이 높다[52]. 이상의 관리 내용들을 요약하면 table 2 와 같다.
결론
앞에서 고찰한 바와 같이 위암 경험자는 암 치료 후 장기간이 지나도 치료로 인한 증상과 영양장애, 골다공증 등의 만성질환, 새로운 암에 대한 위험, 불안과 우울 등 다양한 신체적, 정신적 문제를 가지고 있다. 장기 위암 경험자들에 대한 포괄적인 건강관리를 제공하기 위해서는 지역사회의 일차의료기관의 참여가 요구되며, 암 치료 전문기관에서 지역 사회 기관으로 재의뢰 시의 암 치료 병력 요약지의 제공이나 일차진료의용 진료가이드들이 제공되어야 할 것이다.
Peer Reviewers' Commentary
본 논문은 급증하고 있는 암 치료 후 생존자의 관리전략을 다빈도암인 위암을 바탕으로 전개하고 있다. 위암치료의 최신지견과 추적관리 방안을 잘 간추려 소개하고 있으며, 위암경험자의 이차암 예방을 위한 검진의 필요성도 잘 짚어주고 있다. 또한 위암경험자의 후기합병증 및 동반질환 관리, 생활습관관리 등을 요약함으로써 일차진료에서 포괄적인 건강관리가 가능하도록 진료가이드를 제시하였다. 암 치료 후 생존자가 나날이 증가하고 있는 현 시점에서, 장기생존자의 적극적인 관리를 위한 방안을 다양한 관점에서 제공했다는 점에서 의의가 있는 논문이라 판단된다.
[정리: 편집위원회]