폐암 검진 권고안
The Korean guideline for lung cancer screening
Article information
Abstract
Lung cancer is the leading cause of cancer death in many countries, including Korea. The majority of patients are inoperable at the time of diagnosis because symptoms are typically manifested at an advanced stage. A recent large clinical trial demonstrated significant reduction in lung cancer mortality by using low dose computed tomography (LDCT) screening. A Korean multisociety collaborative committee systematically reviewed the evidences regarding the benefits and harms of lung cancer screening, and developed an evidence-based clinical guideline. There is high-level evidence that annual screening with LDCT can reduce lung cancer mortality and all-cause mortality of high-risk individuals. The benefits of LDCT screening are modestly higher than the harms. Annual LDCT screening should be recommended to current smokers and ex-smokers (if less than 15 years have elapsed after smoking cessation) who are aged 55 to 74 years with 30 pack-years or more of smoking-history. LDCT can discover non-calcified lung nodules in 20 to 53% of the screened population, depending on the nodule positivity criteria. Individuals may undergo regular LDCT follow-up or invasive diagnostic procedures that lead to complications. Radiation-associated malignancies associated with repetitive LDCT, as well as overdiagnosis, should be considered the harms of screening. LDCT should be performed in qualified hospitals and interpreted by expert radiologists. Education and actions to stop smoking must be offered to current smokers. Chest radiograph, sputum cytology at regular intervals, and serum tumor markers should not be used as screening methods. These guidelines may be amended based on several large ongoing clinical trial results.
검진 근거문과 근거수준
30갑년 이상의 흡연력을 가진 55세 이상의 고위험군(금연 후 15년 이상인 과거흡연자는 제외)을 대상으로 매년 시행하는 저선량 흉부 CT를 이용한 선별검사는 폐암특이사망률과 전체사망률을 감소시킬 수 있다는 높은 수준의 근거가 있고, 검진으로 인한 손해보다는 이득이 중등도로 높다고 평가된다.
검진 권고안과 권고등급
(1) 30갑년 이상의 흡연력이 있는(금연 후 15년이 경과한 과거 흡연자는 제외) 55-74세인 고위험군을 대상으로 저선량 흉부 CT를 이용한 폐암선별검사를 매년 시행할 것을 권고한다(권고등급 B).
(2) 흉부 X선, 객담 세포진 검사 및 현재까지 개발된 carcinoembryonic antigen, squamous cell carcinoma anti-gen, CYFRA 21-1, neuron specific enolase 등 혈청 종양표지자를 이용한 폐암 선별검사는 권고하지 않는다(권고등급 D).
검진의 이득과 위해
(1) 검진의 이득
미국에서 시행한 양질의 근거를 가진 대규모 단일 무작위배정 비교임상시험 결과, 30갑년 이상 흡연력을 가진 고위험군을 대상으로 저선량 흉부 CT를 이용한 폐암 검진은 단순 흉부 X선을 이용한 대조군과 비교 시 폐암특이사망률을 약 20%, 전체사망률을 약 7% 감소시킨다.
(2) 검진의 위해
저선량 흉부 CT를 이용한 폐암검진은 발견된 결절을 양성으로 판정하는 기준에 따라 차이가 있지만, 양성률(비석회화 결절 발견율)이 20-53%로 높아 이차적 진단에 대한 부담이 있다. 검사 양성자(비석회화 결절 발견자)중 일부는 침습적 진단검사를 받는 중 합병증이 발생할 수 있다. 또한, 저선량 흉부 CT의 반복적인 촬영에 의한 방사선 피폭은 암을 유발할 수도 있다.
임상에서의 고려사항
(1) 현재 흡연자의 경우 흡연력을 확인하여 폐암검진 대상 여부를 결정하는 것도 중요하지만, 적극적으로 금연을 권고하고, 금연보조약물 등을 이용하여 흡연자의 금연을 돕는 것이 더욱 중요하다.
2) 우리나라는 결핵 유병률이 높아서 위양성 병변이 서구에 비해 높을 가능성과, 저선량 흉부 CT 검사의 판독 경험이 축적된 전문가가 많지 않은 상황을 감안하여 적절한 검사의 질이 확보된 여건에서 검진을 실시하는 것이 바람직하다.
서론 및 배경
우리나라의 2012년 암 발생 통계에 의하면 폐암은 남성 10만 명당 61.0명, 여성 10만 명당 26.8명에서 발생하여, 남성에서 발생한 전체 암의 13.7%로 3위, 여성에서 발생한 전체 암의 6.0%로 5위의 발생순위를 차지한다. 특히 연령군별 암 발생률을 살펴보면 65세 이상 고령자에서 폐암은 위암에 이어 두 번째로 많이 발생하는 암종이다. 2012년 암 사망 통계는 폐암이 남자 암 사망의 26.2%, 여자 암 사망의 16.4%를 차지하여, 남녀 모두 암종별 사망률 1위를 기록하였다[1]. 우리나라 폐암의 5년 상대생존율은 20.7%인데, 병기에 따른 폐암의 5년 상대생존율은 병기가 증가할수록 급격히 낮아져서 국한 병기의 생존율은 46.3%에 이르지만 원격전이가 있는 4기 폐암에서는 4.8%까지 감소한다[2].
최근 미국에서 시행된 대규모 무작위배정 비교임상시험은 폐암 발생 고위험군을 대상으로 저선량 흉부 컴퓨터단층촬영(computed tomography, CT)을 이용한 폐암검진이 흉부 X선 검진을 했던 대조군과 비교하여 폐암 사망률을 약 20% 낮춘다는 것을 보여주었다[3]. 이러한 연구를 바탕으로 국외적으로 폐암검진 권고안이 발표되고 있는 시점에서 폐암검진이 폐암관련 사망과 질병부담의 감소에 효과적인 지에 대한 체계적인 평가를 통해 우리나라 폐암검진 권고안을 도출할 필요성이 제기되었다. 이에 국내 관련 학회들, 즉 대한폐암학회, 대한결핵 및 호흡기학회, 대한흉부외과학회, 대한영상의학회, 대한가정의학회, 대한예방의학회 및 국립암센터로부터 추천 받은 다학제 전문가로 폐암 검진 권고안 제정위원회를 구성하여, 우리나라 암 사망률 1위인 폐암에 대한 근거중심의 검진 권고안을 개발함으로써 의료인들에게 폐암 검진의 표준지침과 검진의 효과 및 위해에 대한 정보를 제공하고자 하였다.
개발방법
폐암 검진 권고안 제정위원회는 기존에 발표된 폐암 검진 관련 지침(권고안)을 검토하고, 검진의 효과(사망률 감소, 질병 중증도 감소)와 위해를 평가하기 위하여 핵심질문을 도출한 후 체계적인 문헌 고찰을 통해 폐암 검진의 효과에 대한 의과학적 근거를 평가하였다(Figure 1). 위원회는 2012년 미국에서 폐암 검진 효과에 관한 대규모 무작위배정 비교임상시험인 'National Lung Screening Trial (NLST)'의 결과 발표 후에 개발된 근거중심의 폐암 선별검사 임상진료지침을 PubMed, National Guideline Clearing House(NGC), US Preventive Service Task Services (USPSTF)에서 검색하였다. 검색된 임상진료지침을 대상으로 지침당 2인 이상의 독립적인 연구자가 AGREE II 도구를 이용하여 지침의 질을 평가하여 근거에 기반하여 개발된 질 높은 권고안을 선별하여 본 지침의 근간으로 삼기로 하였다. 또한 2012년 이후 출판된 저선량 흉부 CT와 사망률을 다룬 무작위배정 비교임상시험 연구가 존재하는지를 파악하기 위한 최신의 1차 문헌을 검색하여 고찰하였고, 출판연도와 상관없이 폐암 검진과 관련된 국내문헌을 검토하여 외국연구에 기반한 권고안의 근거를 국내 폐암검진 권고안의 근거로 받아들이고, 국외 권고안을 수용개작 하는 것이 타당한지 검토하였다. 폐암 선별검사 임상진료지침과 최신 문헌 검색을 위한 검색어는 'lung,' 'cancer or neoplasm,' 'screening,' 'early detection or early diagnosis'를 포함하였다. 국내문헌 검색은 추가적으로 한국어 검색어인 '폐암,' '선별,' '검진,' '조기 발견,' '조기 진단'을 포함하였다. 저선량 흉부 CT를 이용한 검진의 위해에 대해서는 연구 디자인에 제한을 두지 않고, 체계적 문헌 검색을 실시하였다.
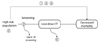
Analysis framework of lung cancer screening guidelines. ① Benefits of screening, ② harms of screening, ③ primary population of and screening, ④ frequency and period of screening, ⑤ other screening methods, ⑥ quality control of screening. CT, computed tomography.
검색된 최신의 국외 문헌과 국내 문헌을 대상으로 문헌마다 2인의 검토자가 독립적으로 문헌 선택 또는 배제를 진행하였다. 일차로 제목과 초록을 보고 선택, 배제를 하였으며 1인이라도 선택한 문헌은 원문을 평가하였다. 원문을 대상으로 폐암 검진 권고안 제정 실무위원회의 위원들이 선택, 배제를 하였으며, 위원들 간에 의견 일치가 이루어지지 않은 경우 합의를 통해 최종 선택, 배제를 결정하였다.
폐암 검진의 이득과 관련해서는 검진으로 인한 사망감소와 병기변화를 평가하였고, 검진의 위해와 관련해서는 검진으로 인한 위양성률, 진단과정에서의 손상, 과진단 여부, 방사선 위해 등을 광범위하게 평가하여, 폐암 검진의 이득과 위해의 크기를 검토하였다. 검진의 효과를 높이고 위해를 최소화시킬 수 있는 방안으로 관리되어야 할 검진의 질에 대해서도 검토하였다. 또한 이번 권고안에서는 저선량 흉부 CT 외에 지금까지 임상에서 사용하고 있는 폐암검진 방법들에 대한 근거도 평가하여 권고안에 제시하였다. 선별된 질 높은 권고안이 근거로 삼은 원자료를 추출하여, 추가적인 1차 문헌과 함께 Cochrane 웹사이트에서 제공하는 RevMan (review manager) 프로그램을 이용하여 메타분석을 실시하였다. 메타분석 결과를 바탕으로 GRADE profiler 프로그램을 활용하여 근거수준 평가와 권고 등급을 결정하였다. 체계적 문헌 검토와 근거 수준 평가 과정은 국립암센터가 개발한 '국가암검진 권고안 제개정 연구 방법론'에 따라 진행하였다.
결과
1. 검진 관련 임상진료지침 및 문헌검색 결과
2012년 이후 발간된 폐암 선별검사에 대한 임상진료지침 검색 결과 302개의 지침이 1차 검색되었고, 중복배제 후 질 평가를 통해 국내 개발 지침 1개를 포함한 총 6개의 임상진료지침이 수용개작의 대상으로 선정되었다 (Figure 2).
기존 폐암 검진 관련 임상진료지침 발표 이후 새로이 보고된 저선량 흉부 CT를 이용한 검진의 효과를 평가한 무작위배정 비교임상시험 연구가 존재하는지를 검색한 결과, 230건의 문헌이 검색되었으나 평가위원 2인의 독립적인 평가 상 지침의 수용개작에 추가할 문헌은 발견되지 않았다. 연구 디자인에 제한을 두지 않고 검색한 저선량 흉부 CT의 위해와 관련된 116건의 문헌이 검색되었고, 평가위원 2인 의 독립적인 평가 결과 35건의 문헌이 위해 평가를 위하여 검토해야 할 것으로 선택되었다. 국내문헌 검색 결과, KoreaMed 198개, KISS 52개, National Digital Science Library 92개, PubMed 238개가 검색되었고, 1, 2차 배제를 통해 2편의 문헌이 선택되었다.
2. 핵심 질문별 근거의 요약
1) 선별검사의 이득
폐암 검진 임상진료지침의 근거가 되는 4개의 무작위배정 비교임상시험은 Table 1과 같다. 미국에서 시행된 NLST 연구는 26,722명의 저선량 흉부 CT군과 26,732명의 흉부 X선 대조군의 비교연구로 검사는 1년 간격으로 총 3회 시행하였다. 연령분포는 55-74세이며, 30갑년 이상의 흡연력을 가진 현재흡연자 또는 같은 흡연력을 가진 금연 15년 미만의 과거흡연자를 대상으로 진행하였다[3]. 이탈리아에서 시행한 Detection and Screening of Early Lung Cancer by Novel Imaging Technology and Molecular Essays (DANTE) 연구는 1,276명의 저선량 흉부 CT군과 1,196명의 CT를 제외한 일반적인 관리를 받은 대조군의 비교연구로 검사는 1년 간격으로 총 5회 검사를 시행하였다[4]. 덴마크의 Randomised Danish Lung Cancer Screening Trial (DLCST) 연구는 2,052명의 저선량 흉부 CT군과 2,052명의 일반적인 관리(매년 외래 방문)를 받은 대조군의 비교연구로 검사는 1년 간격으로 총 5회 시행하였다[5]. 역시 이탈리아에서 시행된 Multicentric Italian Lung Detection (MILD) 연구는 1,190명의 저선량 흉부 CT 매년 시행군과 1,186명의 저선량 흉부 CT 매 2년 시행군, 1,723명의 일반적인 관리를 받은 대조군의 비교연구로 검사 횟수는 매년 시행군의 경우 5회, 매 2년 시행군의 경우 3회 시행하였다[6]. DLCST 연구나 MILD 연구는 NLST 연구나 DANTE 연구에 비해 참여자의 평균 나이나 흡연력이 낮은 편이었다. 각 연구의 평가 결과 모든 연구가 배정순서 은폐에 대한 기술이 불확실하였다. NLST 연구를 제외한 나머지 연구는 모두 충분한 추적관찰기간을 만족하지 못하였으며 DANTE 연구와 MILD 연구는 비교군간 추적관찰기간의 차이가 존재하였다. 특히 MILD 연구는 무작위순위생성에 대한 기술이 불확실하였다. 해당 연구결과들의 이질성을 설명할 수 있는 성별, 연령, 인종의 차이에 따른 민감도 분석은 가능하지 않았다.
NLST 연구만 저선량 흉부 CT군의 폐암특이사망률 상대위험도 0.80 (95% 신뢰구간, 0.70-0.92; number needed to screen [NNS], 320), 전체사망률 상대위험도 0.93 (95% 신뢰구간, 0.88-0.99; NNS, 219)으로 통계적으로 유의한 차이가 있었으며 나머지 세 연구는 저선량 흉부 CT 선별검사가 폐암특이사망률과 전체사망률의 개선을 보여주지 못했다. 무작위순위생성에 대한 기술이 불확실하여 질이 낮다고 평가된 MILD 연구를 제외한 나머지 3개의 무작위배정 비교임상시험만을 대상으로 메타분석을 시행하였다. NLST 연구와 타 연구간의 연구규모, 바이어스 위험(무작위배정, 불충분한 결과자료)에 이질성이 존재하여 양적인 합성은 수행하지 않고 각각의 연구결과를 독립적으로 제시하였다(Figure 3). 각 연구결과의 지침반영 여부에 대한 위원회 논의결과, 본 지침에서는 양질의 연구설계와 수행이 이루어져 높은 근거수준을 가진 것으로 평가된 NLST 연구를 가장 중요한 근거로 삼아 권고안을 작성하기로 결정하였다.

Effects of low dose computed tomography (LDCT) screening on (A) death from lung cancer and (B) all cause mortality. IV, inverse variance; CI, confidence interval; NLST, National Lung Screening Trial; DANTE, Detection and Screening of Early Lung Cancer by Novel Imaging Technology and Molecular Essays; DLCST, Danish Lung Cancer Screening Trial.
2) 선별검사의 위해
저선량 흉부 CT 선별검사 양성률(비석회화 결절 발견율)은 연구에 따라 매우 다양하여 20-53%로 보고되었다. NLST에서 저선량 흉부 CT 선별검사 시행군의 양성률은 24.2%, 흉부 X선 시행군의 양성률은 6.9%였다. 폐암 선별검사의 위해를 고려할 때 중요한 것은 선별검사 양성자를 이차적으로 진단하면서 생기는 합병증이다. 추적 영상촬영이 시행되고, 때로는 기관지내시경, 세침생검, 혹은 수술과 같은 침습적인 절차를 수행해야 되는 경우가 있다. NLST에서 저선량 흉부 CT 선별검사 양성자 중에서 56.5%가 추가 영상촬영을 하였고, 5.9%가 침습적인 진단검사를 받았고 이들 중 폐암으로 확진된 사람은 57.5%이었다. 이때 시행된 침습적 진단검사는 경피적 세침흡인 혹은 생검 1.8%, 기관지내시경 3.8%, 수술적 처치 4.0%이다. 폐암 환자로서 침습적인 진단검사를 받은 사람 중 11.8%에서 주요 합병증이 발생하였고, 1.5%는 침습적인 검사를 받은 후 60일 이내에 사망하였으나 침습적인 과정 자체가 사망과 연관되어 있는지는 보고되지 않았다. 침습적 진단검사를 받은 사람들 중 폐암이 아닌 것으로 밝혀진 42.5%에서는 침습적 진단검사 시행 후 2.4%에서 주요 합병증이 발생하였다.
암 선별검사에서 과진단은 환자가 암이 아닌 다른 원인으로 사망할 것인데도 검사를 시행하여 암이 있다고 진단하는 경우이다. 최근 이탈리아에서 수행된 50세 이상 흡연자 5,203명을 대상으로 한 코호트연구는 5년 동안 매년 저선량 흉부 CT 선별검사를 실시하여 폐암이 진단된 경우에 용적배가시간을 측정하였다. 용적배가시간은 과진단의 지표가 될 수 있어 용적배가시간을 이용하여 선별검사에서의 잠재적인 과진단 크기를 추정하였다. 코호트 참여자 중 기저시점 저선량 흉부 CT 선별검사에서 55명의 폐암이 진단되었고, 추후 이루어진 저선량 흉부 CT 선별검사에서 120명이 폐암으로 진단되어 총 175명이 진단받았다. 추후 저선량 흉부 CT 선별검사로 발견된 120명의 폐암에서 19명(15.8%)은 새로이 발생한 폐암이었고, 101명(84.2%)은 이전에 발견된 결절이 커져서 진단된 폐암이었다. 이중 70명(58.3%)는 용적배가시간이 400일 미만이었고 31명(25.8%)는 용적배가시간이 400일 이상이었는데, 용적 배가시간이 400일을 넘는 경우 과진단의 가능성이 있는 것으로 평가하였다[7]. 결과적으로 폐암에 대한 저선량 흉부 CT 선별검사는 유의한 정도의 과진단 가능성이 있는 것이다.
CT 장비와 촬영법에 따라 다를 수 있지만 저선량 흉부 CT를 1회 검사할 때 노출되는 방사선량은 0.6-1.5 mGy 정도이다. 저선량 흉부 CT를 4회 시행하였을 때 누적 방사선 피폭량은 6-7 mGy, 양전자단층영상촬영 CT의 피폭 방사선량은 약 14 mGy이며 지구상의 자연 방사선 연평균 피폭량은 약 2.4 mGy 정도이다. NLST에서는 2년 동안 선별검사와 진단을 위한 검사까지 고려하여 일인당 피폭 방사선량을 8 mGy 정도로 계산하였다. 현재까지 저선량 흉부 CT 선별검사로 인한 폐암 발생 위험에 대해서는 정확히 알려져 있지 않으며 방사선 위해는 원폭 생존자 및 방사선 종사자 노출에 대한 연구에 근거하여 추론하고 있다. 이런 추론에 근거하였을 때 NLST에서 저선량 흉부 CT 선별검사 받은 사람 2,500명 중 1명이 방사선 피폭으로 인한 암 사망 위험이 있는 것으로 추정되었다[8]. 그러나 이 연구에 사용된 5 mGy의 방사선 피폭량은 현재 사용되는 장비에 비해 3-6배나 많은 피폭량이므로 이것을 감안하면 폐암에 대한 저선량 흉부 CT 선별검사에 의한 방사선 피폭으로 암이 유발될 수도 있지만 위해도는 낮을 것으로 평가된다.
3) 선별검사의 권고대상
현재까지 폐암 선별검사로서 저선량 흉부 CT를 시행하였을 때 폐암 사망률이 감소함을 입증한 주요 근거인 NLST의 연구 대상자와 같이 최소 30갑년 이상의 흡연력이 있는 현재 흡연자 또는 과거 흡연자로서 금연한지 15년이 경과하지 않은 55-74세의 사람들이라는 기준으로 검진 대상자를 선별하는 것이 근거 중심적 판단일 것이다. NLST 연구에는 과거에 폐암으로 진단 받았던 병력, 지난 1년 동안 폐암의 관련 증상일 가능성이 있는 객혈, 7 kg 이상의 원인 미상의 체중 감소가 있었던 사람들은 선별검사 대상에서 제외되었다. 선별검사 중 발견되는 이상 병변에 대한 추가 검사와 폐암으로 진단되었을 때 근치적 치료를 받을 수 있는 체력 조건을 가져야 하므로, 선별검사는 증상이 없는 건강한 사람을 대상으로 시행되어야 한다. 선별검사의 위양성을 줄이기 위하여 최근 3개월간 호흡기 감염이 없는 경우를 연구대상으로 하였다.
NLST에서 정의되었던 고위험 이외의 사람들에게 저선량 흉부 CT 선별검사를 확대 적용하는 것은 근거가 없으므로 현시점에서는 합당하지 않다. 근거는 없으나 전문가 견해로서 선별검사 대상의 확대를 제안한 것을 소개하면 다음과 같다. National Comprehensive Cancer Network에서는 50-54세이고 금연 기간을 고려하지 않은 20갑년 이상의 흡연력이 있으면서 폐암 발병의 위험인자로 알려진 라돈 피폭, 폐암의 가족력, 만성폐쇄성폐질환 또는 폐섬유증에 해당하는 폐질환 병력, 위험한 직업력(실리카, 카드뮴, 석면, 비소, 베리리움, 크롬, 디젤배기가스, 니켈 등 폐암 발암물질에 피폭되는 작업장) 또는 암병력(폐암에서 완치되었던 경우, 임파종, 두경부암, 식도암 등 흡연과 관련성이 있는 암의 병력자) 중 하나 이상의 요인을 가진 사람들도 검진 대상으로 제시하였다[9]. American Association of Thoracic Surgery에서는 이차 폐암의 발생 위험이 높은 폐암 완치 후 5년이 경과한 사람들도 검진 대상군으로 추천한다. 또한 50세 이상, 20갑년 이상의 흡연력과 폐암 발생의 위험인자인 만성폐쇄성폐질환, 환경 또는 직업적 위험성 노출, 암 병력, 가족력이 있는 경우 폐암 선별검사의 대상이 될 수 있을 것이라고 하였다[10]. 비교를 위하여 본 권고안의 수용 개작 대상이 되었던 6개의 국내외 권고안에서 제시한 검진 대상자들을 Table 2에 요약하였다[91011121314].
4) 선별검사의 주기 및 지속
NLST에서 1년 주기로 3번 저선량 흉부 CT 선별검사를 실시하여 폐암특이사망률을 20% 낮추었지만, 선별검사를 전생애 동안 계속해서 지속할 때 혹은 1년에 한번 실시하던 시행 주기를 다양하게 변경하여 지속할 때 나타날 이득과 위해는 달라질 것이다. 그러나 현재까지 나와 있는 이득 및 위해에 대한 근거는 NLST 연구 결과밖에 없다. USPSTF에서 선별검사 대상자 선정기준과 시행 주기를 다양하게 변경하여 전생애 동안 저선량 흉부 CT 선별검사를 반복하여 지속적으로 실시할 때 얻어지는 효과와 위해의 크기를 알아보기 위한 시뮬레이션 연구를 수행한 결과 최적의 선별검사 시나리오는 30갑년 이상의 흡연력이 있는 55-80세의 흡연자와 금연한지 15년 이내인 동등한 흡연력을 가진 과거 흡연자를 대상으로 저선량 흉부 CT를 일 년에 한 번씩 반복적으로 지속하여 실시하는 경우였다[15].
5) 권고하지 않는 선별검사방법
1993-2001년 동안 55-74세의 154,901명을 대상으로 폐암 선별검사로서 흉부 X선 사진을 매년 4회 촬영한 대상자들을 선별검사를 시행하지 않는 일반적인 사람들과 2009년 12월까지 최장 13년간 비교한 연구(Prostate, Lung, Colo-rectal and Ovarian Trial, PLCO) 결과에서 두 군 사이의 폐암 사망률에 차이가 없었다(risk ratio [RR], 0.99; 95% 신뢰구간, 0.87-1.22; P=0.48)[16]. 81,303명의 흉부 X선 사진으로 선별검사를 시행한 4개의 임상연구를 메타분석한 연구에 의하면 흉부 X선 사진을 4-6개월마다 자주 검사했던 사람들은 일반적인 검진을 권고받아 1-3년마다 필요에 따라서 검사를 시행했던 사람들보다 폐암 사망률이 11% 증가하는 결과를 보였다 (RR, 1.11; 95% 신뢰구간, 1.00-1.23)[17]. 흉부 X선 사진을 선별검사 방법으로 하지 말 것을 권고하는 것은 타당하지만, 이것이 호흡기 증상이 있는 환자들에서도 흉부 X선 사진의 역할이 부족할 것이라는 의미는 아니다.
미국에서 시행된 매년 흉부 X선 촬영을 하고 4개월마다 객담 세포진 검사를 추가하였던 두 임상연구를 통합 분석한 결과는(n=20,426) 객담 세포진 검사를 흉부 방사선 촬영에 추가하여도 폐암 사망률을 의미 있게 감소시키지 못했다(RR, 0.88; 95% 신뢰구간, 0.74-1.05)[181920]. 그러나 이 연구의 하위분석에서는 편평상피암이면서 흡연량이 상대적으로 많았던 경우에는 폐암 사망률 감소(RR, 0.81; 95% 신뢰구간, 0.67-1.00)의 가능성을 제시하였으나, 그 이후에 후속 연구로 입증된 바가 없으므로 현재로서는 객담 세포진 검사를 폐암 선별검사로 권고할 수 없다.
Carcinoembryonic antigen, squamous cell carcinoma antigen (SCC-Ag), CYFRA 21-1, neuron specific eno-lase 등 여러 종류의 종양표지자에 대하여 조기 폐암에 대한 진단적 가치를 조사하였으나 어떠한 것도 조기 폐암 진단을 위한 충분한 진단적 민감도와 특이도를 충족시키지 못하므로 현재로서는 종양 표지자를 폐암 조기 선별검사로 사용하는 것을 권고하지 않는다[2122]. 다만 종양 표지자는 이미 진단된 폐암 환자의 경과치료 효과나 예후 평가에 사용될 수도 있다.
6) 검사의 질 관리
현재 유일하게 저선량 흉부 CT의 폐암 검진 효과를 보고한 NLST 연구에서는 4채널 이상의 다중검출기로 촬영하였다. 최근에는 추가 촬영 없이 결절을 후향적으로 재구성이 가능한 해상력을 갖춘 64채널 이상의 다중검출기로 절편 두께를 1.5 mm 이하로 촬영하는 것을 권고하고 있다[23]. 폐암의 가능성이 있는 간유리 음영의 결절을 판정하기 위해서는 최소 2.5 mm 이하의 절편 두께가 요구되며 이를 위해서는 최소한 16채널 다중 검출기를 사용하여야 한다[24].
NLST에서 폐암 검진을 위한 저선량 흉부 CT를 시행한 기관의 85% 이상은 400병상 이상의 대학병원으로서 각 분야 전문의들(영상의학, 호흡기, 흉부외과, 해부병리, 종양내과의 등)에 의해 다학제 진료가 가능한 기관에서 시행되었으며, 여러 국외 권고안에서도 폐암검진이 가능한 기관은 종합적인 진료가 가능해야 함을 명시하고 있다. 그러나, 우리나라의 경우 검진을 전문적으로 시행하는 기관들이 적지 않음을 고려하여, NLST 기준에 부합하지 않는 종합병원 외의 기관에서 폐암검진을 시행할 경우에는 반드시 상근하는 영상의학과 전문의가 있고, 16 채널 이상의 다중검출기가 있는 의료기관에서 시행할 것을 권고한다[12]. 저선량 흉부 CT는 표준체중의 수검자인 경우 방사선량을 1.5 mGy 수준으로 촬영할 것을 권고하며, 체질량지수가 30 이하인 경우 3 mGy, 체질량지수가 30 이상인 경우 5 mGy를 넘어서는 안 된다. 폐암으로 의심되는 소견이 발견되는 경우 다학제 진료가 가능한 종합병원으로 의뢰해야 한다. 폐암검진 저선량 흉부 CT 판독 의사의 자격은 NLST와 대한흉부영상의학회의 폐암검진 권고안 대로 판독 경험이 풍부한 영상의학과 전문의로 제안한다. CT의 결과 판정 및 결절의 분류와 이에 따른 추적 검사 및 CT의 질관리에 대한 권고는 대한흉부영상의학회에서 제안한 한국형 폐암검진 저선량 흉부 CT 판독 양식 및 권고안을 따르도록 한다[12].
고찰
이번 권고안에서는 30갑년 이상의 흡연력이 있는(금연 후 15년이 경과한 과거 흡연자는 제외) 55-74세인 고위험군을 대상으로 저선량 흉부 CT를 이용한 폐암선별검사를 매년 시행할 것을 권고하였다. 우리나라는 결핵 유병률이 높아서 위양성 병변이 서구에 비해 높을 가능성과, 저선량 흉부 CT 검사의 판독 경험이 축적된 전문가가 많지 않은 상황을 감안하여 적절한 검사의 질이 확보된 여건에서 검진을 실시하는 것이 바람직하다고 제시하였다. 반면에 흉부 X선, 객담 세포진 검사 및 현재까지 개발된 carcinoembryonic antigen, squamous cell carcinoma antigen, CYFRA 21-1, neuron specific enolase 등 혈청 종양표지자를 이용한 폐암 선별검사는 시행하지 말 것을 권고하였다 (Table 3). 이는 무증상인을 대상으로 검진의 효과를 비교 평가한 여러 연구에서 검진을 통한 폐암 사망률을 유의하게 감소시키지 못했고, 조기 폐암 진단을 위한 검사의 정확도도 낮았기 때문이다.
폐암 검진 권고안 제정위원회에서는 일차연구인 무작위배정 비교임상시험 NLST, DANTE, DLCST, MILD 연구 중에서 NLST 연구만을 타당한 근거로 놓고 권고안을 만들 것을 결정하였고 그 결과 고위험군을 대상으로 매년 시행하는 저선량 흉부 CT는 폐암사망률을 20% (NNS 320), 전체사망률을 7% (NNS 219) 낮춘다는 결과를 채택하였으나 아직 이같은 결과를 보인 비교임상시험이 한 개에 불과하고, 동반 질병과 폐암 발생 역학이 외국과 동일하다고 확신할 수 없는 상황에서, NLST 연구의 수행 방법틀을 국내의 지침에 그대로 적용할 수 있는 견고한 근거라고 보기에는 제한점이 있다.
미국에서 흡연에 의한 사망자 중에 폐암으로 인한 사망이 28-35%이고, 나머지는 호흡기질환, 심혈관질환, 대사질환, 기타 암 등으로 사망한다[25]. 일차예방인 금연은 폐암 사망 외에 심혈관질관, 호흡기질환으로 인한 사망을 낮추는 효과가 있는 반면에 폐암 선별검사는 완치 가능한 조기 폐암을 찾아내고 진행성 폐암을 예방하여 폐암 사망만을 낮추는 효과가 있으므로 폐암 선별검사를 시행함과 동시에 대상 흡연자들에게 금연을 유도하는 것이 매우 중요하다.
저선량 흉부 CT를 이용한 폐암 선별검사의 양성률은 양성 결절을 어떻게 정의하느냐에 따라 그 결과가 매우 다양하게 나타난다. 모든 비석회화 결절을 양성으로 판단한 경우는 양성률이 20-53%였지만, 결절의 부피 500 mm3 이상과 용적배가시간 400일 미만을 기준으로 양성을 정의하였던 NELSON 연구의 양성률은 6%였고, 위양성률은 단지 1.2%에 불과하였다[26]. 우리나라의 경우 외국에 비해 결핵 유병률이 높아서 저선량 흉부 CT를 이용한 폐암 선별검사에서 양성률은 더 높을 것으로 예상되므로 NLST에서의 검사 양성 기준을 우리나라에 그대로 적용하였을 때의 문제점에 대해 고려해야 한다. 만약 NLST에서의 양성기준으로 판정하였을 때 우리나라에서의 양성률이 너무 높다면, NELSON 연구에서 도입한 결절의 부피와 용적배가 시간을 기준으로 양성 결절을 판정하는 것을 검토해 볼 수 있다. 폐암 선별검사를 위하여 저선량 흉부 CT를 시행하는 경우 양성결절에 대한 추적검사와 침습적 진단을 시행하는 근거 중심적 기준을 마련해야 한다.
본 권고안에서 제시한 검진 대상자는 NLST에서 채택하였던 기준과 동일하다. 미국에서 시행된 NLST의 기준을 우리나라에 적용 가능할지에 대해서는 검사 대상에 포함되는 양국민의 기대여명을 비교해야 하는데, 우리나라 75세 국민의 2012년 기대여명 통계(남녀 평균 12.38년, 남자 10.46년, 여자 13.52년)와 미국인 75세 국민의 2008년 기대여명 통계(남녀 평균 11.7년, 남자 10.6년, 여자 12.5년)가 비슷하였다[2728]. 또한 폐암의 진행 정도에 따른 5년 생존율을 국가별로 비교했을 때 폐암이 국한된(localized) 경우 우리나라는 46.3%, 미국은 52.2%였고, 국소 진행된(regional) 경우 27.2%, 25.1%로 양국의 수술 가능한 폐암 환자의 생존율이 유사했다[2]. 이를 근거로 폐암 환자의 NLST에서 선택한 선별검사 대상자 기준을 우리나라에 적용해도 될 것으로 판단한다.
폐암 선별검사의 대상이 되는 고위험군을 어떻게 정하느냐가 선별검사의 유효성이 결정되므로, 고위험군 기준은 매우 중요한 문제이다. NLST에서 채택하였던 연령과 흡연력을 기준으로 한 고위험군의 정의 외에 직업, 환경, 가족력, 과거력 등 폐암 발생의 위험인자를 반영한 폐암 발생 예측 모델을 개발할 필요가 있다. 우리나라에서도 30-80세의 남자 1,324,804명을 대상으로 폐암 발생 위험인자를 조사한 바 있는데, 1일 1갑 이상의 현재 흡연자, 어린 나이에 흡연을 시작한 경우, 저체중, 적은 신체 활동량, 공복 시 고혈당이 폐암 발생 위험을 증가시키는 것으로 나타났다[29].
폐암 검진의 정확도를 높이기 위한 진단 기준을 마련하고, 검진의 위해를 감소시키기 위한 방안을 마련하는 것은 국가단위로 폐암 검진을 확대 시행하기 전에 반드시 준비해야 하는 중요 과제이다. 특히 저선량 흉부 CT에서 발견되는 폐결절의 적절한 양성 기준을 제시하고, 추적검사 또는 추가적인 진단검사에 대한 가이드라인을 마련하는 것이 필요하다. 2차 원적 측정에 의한 막대한 위양성률은 불필요한 자원의 낭비를 유발하므로 용적배가시간을 가미한 3차원적 측정법 도입이나 바이오마커를 이용하여 위양성자를 줄이는 방법에 대한 연구가 필요하다. 발견된 양성 폐결절에 대한 근거 중심적 진단방법을 다룬 연구는 전무한 실정이며, 이는 폐암 검진의 비용-효과에 직접적인 영향을 미칠 것이므로 주요 연구대상이 될 것이다. 검진 주기를 매년 또는 격년으로 할 것인지, 언제까지 검진을 지속할 지에 대한 연구도 필요하다. 적은 방사선 노출로 양질의 영상을 얻는 기술이 나날이 발전하므로 이를 폐암 선별검사에 도입하는 지속적인 노력과 획득한 영상을 정확히 판독하는 숙련된 전문의를 체계적으로 양성하는 노력도 필요하다. 폐암 선별검사와 별도로 검진 대상자가 되는 장기 흡연자에 대한 금연 진료가 필수적임을 잊지 말아야 한다.
이 보고서는 폐암 선별검사로서 폐암 사망률과 전체 사망률을 감소시킨 대규모 무작위배정 비교임상시험인 NLST 결과를 중요한 근거로 하여 권고안을 마련한 것이지만, 현재 유럽을 중심으로 진행 중인 유사 연구들의 결과를 면밀히 관찰해야 하며 추후 이들 연구 결과가 발표되는 시점에서 새로운 근거에 기반한 수정된 권고안이 마련되기를 기대한다.
결론
30갑년 이상의 흡연력이 있는(금연 후 15년이 경과한 과거 흡연자는 제외) 55-74세인 고위험군을 대상으로 저선량 흉부 CT를 이용한 폐암 선별검사는 폐암사망률과 전체사망률을 감소시킬 수 있다는 높은 수준의 근거가 있고, 검진으로 인한 손해보다는 이득이 중등도로 높다고 평가되므로 매년 시행할 것을 권고한다.
Peer Reviewers' Commentary
본 논문은 미국 폐암검진연구 등을 기반으로 한 메타분석과 검진의 위해에 대한 분석 등을 실시한 후 이를 기반으로 우리나라 폐암검진 권고안을 도출하였다. 우리나라 사망원인 1위 질환인 폐암검진에 대하여 그동안 진료지침이 없어 일선진료 현장에서 혼선이 있어 왔는데 시기적절하게 이를 정리해준 논문으로 평가할 수 있다. 이 논문을 기반으로 하여 조속한 시일 내에 우리나라에서도 폐암검진연구가 시작되길 바라며 이를 통하여 우리나라에 적합한 폐암검진권고안이 마련되기를 기대한다. 나아가 이와 같은 결과가 국가 암 검진사업 등 실제 의료현장에서 적용되어 우리나라 폐암사망률 감소에 일조할 수 있게 되기를 희망한다.
[정리: 편집위원회]