당뇨망막병증의 예방적 관리와 치료
Prevention and management of diabetic retinopathy
Article information
Abstract
Diabetic retinopathy(DR) is the leading cause of new onset blindness among working-aged groups in industrialized countries, and its incidence is expected to increase along with the rising incidence of diabetes mellitus. Primary interventions such as strict glycemic control, tight blood pressure regulation, and lipid-lowering therapy can significantly reduce the risk of DR occurrence and progression. Currently, laser photocoagulation is the mainstay of treatment of proliferative DR and some cases of diabetic macular edema (DME). However, a considerable number of DR patients still suffer from severe visual impairment in spite of the application of laser photocoagulation and even of pars plana vitrectomy. Considering the limitations of current DR treatments, ongoing efforts have been devoted to the development of new therapeutic strategies, and it has become necessary to focus on pharmacologic treatment. Since inflammation has been identified as playing a substantial role in the pathogenesis of DR, corticosteroids with an anti-inflammatory effect can be included in the treatment of DR, though this may cause cataract and intraocular pressure elevation. The recent discovery of inhibitors of vascular endothelial growth factor is a revolutionary event in the management of DR, specifically DME. Some new agents aiming at the process of angiogenesis and increased vascular permeability are still under investigation, offering hope for a more effective future treatment of this sight-threatening disease. This paper reviews the current state of knowledge of the clinical presentation, preventive management, and clinical therapeutic strategies of DR and DME.
서론
당뇨망막병증은 서구 및 우리나라를 포함한 문명화된 국가들에서 실명의 주원인 중 하나로, 다른 주요한 실명유발 질환들과 달리 주로 근로능력을 보이는 연령대에서 새로 발생하는 실명의 원인이 되고 있어 사회경제적으로 큰 부담을 야기하고 있다[1]. 1980년대 당뇨망막병증의 유병률에 관한 대규모 역학조사가 이루어진 이후 최근까지 여러 조사에서 당뇨병 환자들에 있어 당뇨망막병증의 유병률은 감소하는 추세이고, 특히 증식당뇨망막병증으로의 진행과 심각한 시력손상의 위험은 많이 낮아진 것으로 나타나고 있다. 서구의 한 조사에서 제2형 당뇨병 환자의 당뇨망막병증 유병률이 1993년에는 39.4%이었으나 2006년에는 27.5%로 감소하였고, 최근의 또 다른 연구에서는 증식당뇨망막병증이 11%, 심각한 시력손상이 7.2%에서 발생한다고 하여 이전의 연구들에서 보다 감소한 결과를 보이고 있다[23]. 이러한 변화는 당뇨망막병증의 위험요인에 대한 인식의 증가에 따라 망막병증이 발생한 환자들을 조기에 진단, 치료할 수 있게 된 것 과 더불어 혈당조절, 혈압 및 고지혈증의 관리 등 내과적 치료의 개선에 기인한 것으로 생각된다.
그러나 전 세계적으로 당뇨병 환자 수가 증가하는 추세이고, 이러한 관리를 통하여 당뇨망막병증으로 인한 시력손상을 완전히 막을 수 없기 때문에 당뇨망막병증에 대한 지속적인 연구와 치료법의 개발이 요구된다. 본 논문에서는 당뇨망막병증의 임상양상 및 예방을 위한 관리방법, 최근 사용되고 있는 치료법들을 살펴보고 더 나아가 곧 임상에 도입될 수 있는 새로운 약제들에 대하여 알아보고자 한다.
당뇨망막병증의 임상양상
당뇨망막병증은 망막표면의 신생혈관 발생여부에 따라 비증식당뇨망막병증과 증식당뇨망막병증으로 구분된다. 당뇨망막병증의 초기, 즉 경증의 비증식당뇨망막병증에서는 모세혈관 혈관벽이 부분적으로 약화, 원형 확장되어 발생하는 미세혈관류와 망막출혈이 보이며 당뇨망막병증이 진행함에 따라 망막 세동맥의 폐쇄에 따른 망막 내 축삭질 부종인 면화반, 망막정맥이 비정상적으로 확장되며 강낭콩같이 울퉁불퉁한 모습을 보이는 염주정맥, 망막 내 미세혈관이상 등이 발생한다. 이 시기를 지나 시신경유두부위나 망막의 내측표면 위로 비정상적인 신생혈관이 형성되면 증식당뇨망막병증으로 진단한다.
망막혈관의 투과성이 비정상적으로 증가됨에 따라 혈관 외 누출이 생기고, 이러한 누출액에 의하여 망막의 중심부인 황반부의 두께가 증가하게 되는 당뇨황반부종(diabetic macular edema)은 당뇨망막병증의 어느 시기에도 발생할 수 있는데, 당뇨망막병증이 진행함에 따라 그 발생빈도도 늘어나게 된다[4]. 당뇨황반부종은 형태에 따라 군집된 미세혈관류와 동반되어 나타나는 국소황반부종(focal macular edema)과 좀 더 넓은 범위에서의 내측혈액망막장벽(inner blood-retinal barrier)의 손상으로 인한 미만황반부종(diffuse macular edema)으로 나눌 수 있으며, 황반부종으로 인한 시력저하는 비교적 점진적으로 발생하고 중등도의 시력저하를 유발하는데 비하여, 신생혈관으로 인한 출혈이나 견인망막박리 등의 합병증이 발생할 경우에는 중증의 시력저하가 급격히 발생하게 된다.
당뇨망막병증의 진단과 평가를 위한 검사에는 세극등 현미경이나 간접검안경을 이용한 이학적 안저검사뿐만 아니라 안저사진촬영(fundus photography), 형광안저혈관조영술(fluorescein angiography), optical coherent tomography (OCT) 등의 검사법이 활용되고 있다(Figure 1). 특히 OCT 검사는 당뇨황반부종을 진단하고 치료에 대한 반응을 평가하는데 매우 유용한 검사로, 당뇨망막병증에서 황반부종을 정량적으로 평가하고 여러 가지 치료를 시행한 후 황반부의 변화를 측정함으로써 치료의 유용성 확인과 추가적인 치료계획의 수립에 도움을 얻을 수 있다(Figure 2). 더불어 황반부에 견인력을 형성하는 주변조직의 존재여부도 OCT를 통해 확인할 수 있으며, 최근에는 OCT 기술의 눈부신 발전에 힘입어 당뇨황반부종의 병태생리에 대한 이해를 높이는 데에도 기여하고 있다[5].
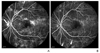
(A) Fluorescein angiography of the left eye demonstrates proliferative diabetic retinopathy stage with new vessels at disc (NVD, arrow) and strong vascular leakage. (B) After panretinal photocoagulation, regression of NVD is noted and vascular leakage is decreased with multiple laser scars (arrowheads).
당뇨망막병증의 예방적 관리
당뇨망막병증의 발생과 진행을 막기 위한 관리는 엄격한 혈당조절을 유지하는 데 일차적인 초점이 맞추어져 왔으며, 고혈압 및 고지혈증도 여러 연구에서 위험인자로 밝혀져 당뇨망막병증의 내과적 치료에 있어서 혈압조절과 혈중지질의 관리 역시 중요성이 강조되고 있다.
1. 혈당조절
엄격한 혈당조절은 제1형과 제2형 당뇨병 환자 모두에서 도움이 되는 것으로 증명되었다. 가장 자세한 정보는 Diabetes Control and Complications Trial (DCCT)와 그 후속연구인 EDIC (Epidemiology of Diabetes Interventions and Complications) 연구를 통해서 얻어졌는데, DCCT 연구의 1993년 보고에서 당화혈색소(HgA1c) 수치를 평균 9.1%로 유지한 보통치료(conventional therapy)군에 비하여 평균 7.2%로 유지한 집중치료(intensive therapy)군에서 당뇨망막병증의 발생률은 76%, 당뇨망막병증의 진행률은 54% 감소된 것으로 나타났다[6]. 이러한 집중치료의 효과는 성인과 청소년 모두에서 확인되었으며, 성인에서는 10년 후에도 유의한 차이가 지속되었다[7]. 또 다른 대규모 임상연구인 UK Prospective Diabetes study (UKPDS)에서는 제2형 당뇨병 환자에서 집중치료가 보통치료에 비하여 10년 간의 경과관찰 중 레이저치료의 필요를 28% 감소시키는 것으로 나타났으며, 두 단계이상의 당뇨망막병증 진행위험은 21% 감소하는 것으로 보고하였다[8]. 혈당조절이 당뇨망막병증의 진행에 미치는 영향에 대한 가장 최근의 연구인 Action to Control Cardiovascular Risk in Diabetes (ACCORD) study는 연구의 일차목적이 심혈관계질환에 맞춰져 있었으나, 2856명의 환자들을 대상으로 한 소집단 분석(subgroup analysis)인 the ACCORD-Eye study에서 집중치료가 표준치료에 비해 두 단계이상의 당뇨망막병증 진행을 억제하는 효과가 있음을 증명하였다[9].
그러나 이렇게 엄격한 혈당조절은 부작용을 동반할 수 있는데, DCCT 연구에서 연구초기(연구시작 후 12개월 이내)에 당뇨망막병증의 악화가 보통치료군에서의 7.6%보다 집중치료군에서 13.1%로 유의하게 더 많이 발생한 것으로 확인되었다. 이러한 초기 악화는 악화를 보인 환자들의 절반에서 18개월 째 회복되었으며, 집중치료를 받은 환자들 중 초기악화가 나타난 환자들도 최종적으로는 보통치료를 받은 환자들과 유사하거나 더 양호한 예후를 보였다[10]. ACCORD 연구에서는 집중치료군에서 의학적 치료를 요하는 저혈당이 3배 더 많이 발생하였으며, 심지어 27%의 사망률 증가 또한 확인되어 임상연구 중 고혈당 환자들을 대상으로 한 부분은 조기종료하게 되었다[11].
마지막으로, 집중치료를 통해 혈당을 더 엄격하게 조절하는 것의 당뇨망막병증에 대한 효과를 알아본 최근의 연구 중에는 당뇨망막병증의 진행을 억제하는 데 이득이 없는 것으로 보고한 연구도 있으며, 집중치료에 관한 대부분의 연구들에서 저혈당 발생의 위험성이 증가하였다는 것도 유의하여야 할 점이다[12].
2. 고혈압 치료
혈압조절과 당뇨망막병증의 발생 및 진행과의 상관관계는 이미 확인된 바 있으며, 고혈압 치료가 당뇨망막병증의 치료에 도움이 된다는 사실도 여러 연구들을 통하여 입증되었다[13141516].
제2형 당뇨병 환자들을 대상으로 한 UKPDS 연구에서는 좀 더 엄격한 혈압관리를 한 군에서 그렇지 않은 군보다 3줄 이상의 시력저하는 47%, 레이저치료의 필요성은 35%, 그리고 당뇨망막병증의 진행은 34% 감소한 것으로 나타났다[13].
당뇨망막병증의 발생과 진행에 대한 angiotensin pathway inhibitor들의 영향을 연구한 세 가지의 전향적 임상시험들은 모두 긍정적인 결과를 얻었는데, EUCLID (EURODIAB Controlled Trial of Lisinopril in Insulin-Dependent Diabetes Mellitus) 연구는 292명의 제1형 당뇨병 환자들을 대상으로 angiotensin converting enzyme (ACE) inhibitor를 투여한 환자군과 위약을 투여한 환자군으로 나누어 두 군을 비교하였을 때 ACE inhibitor 투여군에서 두 단계 이상의 당뇨망막병증 진행과 증식당뇨망막병증으로의 진행이 모두 유의하게 감소한 것으로 보고하였다[17]. DIRECT (Diabetic Retinopathy Candesartan Trial) 연구는 제1형 및 제2형 당뇨병 환자에서 angiotensin receptor blocker (ARB)와 위약의 효과를 비교하였는데 제1형 당뇨병 환자에서는 연구에 사용된 ARB가 당뇨망막병증의 발생은 감소시키는 것으로 나타났으나 당뇨망막병증의 진행에는 영향을 미치지 못한다고 하였고, 제2형 당뇨병 환자에서는 당뇨망막병증의 진행에 있어서는 두 군간에 유의한 차이가 없었으나 ARB 치료군에서 당뇨망막병증의 호전이 나타나 중증도가 유의하게 감소되는 것을 확인하였다[1819]. 가장 최근의 연구인 RASS (Renin-Angiotensin System Study)에서는 285명의 제1형 당뇨병 환자들을 ARB 투여군, ACE inhibitor 투여군, 위약 투여군으로 나누어 5년간 경과 관찰한 결과를 보고하였는데, ARB 투여군과 ACE inhibitor 투여군 모두에서 위약군에 비하여 두 단계이상의 당뇨망막병증 진행이 유의하게 억제되는 것으로 나타났다[20].
3. 고지혈증 치료
이상지질혈증(dyslipidemia) 역시 당뇨망막병증의 위험도를 증가시키는 것으로 알려져 있으며, 혈중지질저하제(lipid-lowering agent)의 사용에 따른 영향을 알아보기 위한 여러 전향적 임상연구들이 진행됐다. 제2형 당뇨병 환자 9,795명을 대상으로 한 Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) 연구에서는 fenofibrate의 사용이 레이저치료의 필요성을 유의하게 낮출 수 있다고 보고하였으며, 비록 전체 환자군에서 두 단계 이상의 당뇨망막병증 진행을 억제하는 데는 위약군과 차이가 없는 것으로 나타났으나, 연구시작 단계에서 당뇨망막병증이 발생하여 있었던 환자들 만을 대상으로 한 소집단 분석(subgroup analysis)에서는 유의한 차이가 있는 것으로 확인되었다[21]. 최근의 ACCORD-Eye 연구에서는 1,593명의 환자들을 대상으로 지질저하제인 simvastatin과 위약을 동시 복용하거나 또는 simvastatin과 fenofibrate을 동시 복용하는 두 군으로 나누어 결과를 분석하였는데(the ACCORD-lipid study), 두 약제를 병용투여 한 환자들에서 당뇨망막병증의 진행이 유의한 정도로 적게 발생하였다(10.2% and 6.5%, P=0.006) [9]. 그러나 이러한 임상연구에서 혈중 지질농도의 변화와 당뇨망막병증과의 관계에 관한 결과들은 그 내용이 상이하게 나타나는데, FIELD 연구에서는 레이저치료의 필요성 감소가 혈중 지질수준과는 연관성을 보이지 않아 fenofibrate의 효과 중 지질 저하작용 이외의 다른 작용기전이 당뇨망막병증에 영향을 주었을 것으로 추론할 수 있다. 반면 ACCORD-Eye 연구에서는 당뇨망막병증에 대한 fenofibrate의 효과가 혈중 지질수치의 호전과 동반되어 나타나는 것으로 확인되었다. 각각의 연구에서 fenofibrate이 지질 수준에 서로 다른 영향을 미친 것인지, 또는 simvastatin과의 동시복용이 상승작용을 나타낸 것인지 여부에 관하여서는 추가적인 연구가 필요할 것이다[22].
당뇨망막병증의 치료
당뇨망막병증의 치료는 과거 수 십 년간 레이저 광응고술이 중심이 되어왔으며, 레이저 치료에 반응이 없거나 증식당뇨망막병증 환자들 중 수술의 적응증이 되는 경우에 한해 유리체절제술이 시행되었다. 그러나 최근에는 당뇨망막병증과 당뇨황반부종의 치료를 위하여 다양한 약물들의 안구내 주입술이 시행되고 있으며, 현재에도 많은 약물들이 개발 중이거나 당뇨망막병증에의 적용을 위한 임상시험이 진행 중이다.
1. 레이저 광응고술
레이저 광응고술(laser photocoagulation)은 시력을 위협하는 당뇨망막병증과 당뇨황반부종에 오랜 기간 사용되어 온 확립된 치료법이다. 범망막광응고(panretinal photocoagulation)는 심한 비증식당뇨망막병증이나 증식당뇨망막병증의 치료를 위해 시행하며, 200-500 µm 크기의 광응고반을 황반를 제외한 부위에 1,200-1,600개 정도 만들게 된다(Figure 1). Diabetic Retinopathy Study (DRS)에서는 이러한 범망막광응고 치료에 의해 심각한 시력손상의 위험을 50% 정도 감소시킬 수 있다고 하였다[23]. Early Treatment Diabetic Retinopathy Study (ETDRS)에서는 당뇨망막병증에서의 망막부종이 황반중심을 침범하였거나 그럴 가능성이 높은 경우를 유의한 황반부종(clinically significant macular edema)으로 분류하였는데, 이러한 황반부종에서 국소레이저치료(focal photocoagulation)는 중등도의 시력손상 위험을 반으로 경감시킬 수 있었다[24]. 치료방법은 황반 중심에서 500 µm 이상 떨어진 부위에 누출을 보이는 미세혈관류와 동반된 망막의 두꺼워짐이 있을 때에는 미세혈관류를 직접 광응고하고, 미만성의 두꺼워진 망막부위(diffuse macular edema)에 대해서는 격자레이저치료(gird photocoagulation)를 시행한다.
레이저치료에 따른 합병증으로는 치료 후의 일시적인 시력저하, 주변 시야의 감소, 야간시력 저하, 우발적인 황반광응고 등이 있다. 범망막광응고 후 가장 흔한 합병증은 치료 후 일시적인 시력저하이며 대개 몇 주일 후 회복된다. 그러나 영구적인 시력저하가 일어나는 경우도 있으며 특히 황반부종이 심한 눈에서 이러한 합병증의 발생위험이 높다. 따라서 이러한 합병증을 예방하기 위하여 황반부종이 동반된 증식당뇨망막병증에서 범망막광응고와 국소레이저치료를 모두 필요로 할 때에는 국소레이저치료를 먼저 시행하여 어느 정도 황반부종이 호전된 후 범망막광응고를 시행하여야 하며, 스테로이드나 혈관내피성장인자(vascular endothelial growth factor, VEGF)에 대한 항체 주사를 레이저치료와 같이 또는 치료 전에 시행하는 것을 고려해 볼 수도 있다[25]. 또한 최근에는 이러한 합병증 발생의 위험을 줄이기 위하여 기존보다 짧은 레이저 조사 주기와 강도를 가진 역치하 다이오드레이저(subthershold micropulse diode laser)를 이용한 치료도 시도되고 있다[26].
2. 스테로이드 주사
염증반응은 당뇨망막병증의 발생에 직접 관련되며, 이전 약 10년간은 triamcinolone을 주로 하는 스테로이드가 당뇨망막병증 및 당뇨황반부종의 치료를 위하여 유리체강 내 주사요법으로 사용되어져 왔다. 스테로이드는 안구 내 신생혈관의 발생을 억제하며 염증성 cytokine과 VEGF에 강력한 길항작용을 나타내므로 당뇨망막병증에서 스테로이드를 사용하여 치료를 시도한 많은 연구들이 보고되었으나, 이러한 스테로이드의 안구 내 주사요법은 백내장의 발생과 안압의 상승과 같은 합병증을 흔히 동반하게 되므로 사용에 주의를 요한다[25]. 레이저치료에 잘 반응하지 않는 당뇨황반부종 환자들을 대상으로 한 2년 간의 무작위배정 임상시험에서 1줄 이상의 시력호전을 나타낸 환자들이 유리체강 내 triamcinolone 주사치료를 시행한 군에서 대조군에 비하여 유의하게 많은 것으로 나타났으나(54% vs. 26%, P=0.006), 스테로이드의 합병증으로 백내장 수술과 고안압증에 대한 치료를 받은 환자들의 비율은 대조군에서 각각 0%와 3%이었던데 비하여 triamcinolone 주사치료를 시행한 군에서는 각각 54%와 44%로 높게 발생하였다[27].
레이저치료와 triamcinolone 주사요법을 이용한 병합치료를 시도한 연구들도 많이 보고되었는데, 그 결과들은 매우 상이하게 나타나서 일부 보고에서는 레이저치료 단독요법에 비하여 triamcinolone과의 병합요법이 치료효과가 더 우수한 것으로 나타났으나, 다른 연구에서는 황반부종의 호전에는 차이가 있으나 시력호전에는 차이가 없는 것으로 보고하였고, 또 다른 연구에서는 triamcinolone의 병합치료 효과는 치료 후 수개월까지 일시적으로 나타나며 이후에는 레이저 단독치료군과 유의한 차이가 없는 것으로 보고하였다[282930].
최근에는 스테로이드의 부작용은 줄이면서 dexamethasone의 안구 내 농도를 수 개월간 유지할 수 있는 sustained-released delivery system을 이용한 유리체강 내 주사약제가 개발되어 당뇨황반부종에의 치료효과에 대한 연구가 진행 중에 있다.
3. 혈관내피성장인자 억제제 주사
레이저치료의 상용화 이후 지난 20 여 년 간 안구 내 신생혈관질환의 병태생리에 대한 많은 연구가 이루어져 신생혈관의 발생, 혈관 투과성의 증가 및 염증에 관여하는 다양한 요인들이 밝혀졌다. 그 중 VEGF는 신생혈관 발생과 혈관 투과성증가를 모두 야기하는 강력한 활성인자로서 당뇨망막병증의 병태생리에 직접적으로 관여한다[25].
현재 사용 가능한 VEGF 억제제는 pegaptanib, bevacizumab, ranibizumab, aflibercept의 네 가지이며 모두 유리체강 내 주사요법으로 사용된다. 가장 먼저 개발되어 임상에 도입된 VEGF 억제제인 pegaptanib은 나선형태의 ribonucleic acid (RNA) 조각으로 이루어진 aptamer로 VEGF165에 선택적으로 결합하며, bevacizumab은 VEGF에 대한 full-length monoclonal antibody이다. Ranibizumab은 bevacizumab과 관련된 구조로 이루어졌으며 VEGF에 대한 monoclonal antibody 중 항원결합부위 만을 분리한 후 VEGF에의 친화성을 높인 약제이다. Aflibercept는 가장 최근에 임상에서 사용 가능하여졌는데 체내의 VEGF 수용체 중 VEGF 결합영역만을 분리하여 다시 재합성한 약제로, pegaptanib을 제외한 나머지 세 약제는 VEGF의 모든 이성체에 결합할 수 있다[31].
Pegaptanib의 유리체강 내 주사요법은 당뇨황반부종을 동반한 제1형과 제2형 당뇨병 환자들을 대상으로 한 전향적 임상시험에서 2년째에 위약 투여군에 비하여 유의한 시력호전을 보였고, 레이저치료를 필요로 하게 된 환자들의 수도 유의하게 적은 것으로 나타났다[32].
Bevacizumab의 유리체강 내 주사치료는 현재로서는 모두 허가 외 사용(off-label treatment)이나, 당뇨망막병증 이외에 삼출성 황반변성과 망막정맥폐쇄증 등을 포함하여 병태생리에 VEGF가 관여하는 많은 망막질환에서 매우 폭넓게 사용되고 있으며 그 유효성이 입증되었다(Figure 2). 당뇨황반부종을 가진 80명의 환자들을 대상으로 반복적인 bevacizuamb주사와 레이저치료의 효과를 비교한 전향적 임상시험인 Bevacizumab or Laser Therapystudy (BOLT)에서는 2년째에 bevacizumab 치료군에서 평균시력향상이 있었던 데 반해 레이저 치료군에서는 시력저하가 발생하였으며, bevacizumab 치료군과 레이저 치료군에서 각각 두 줄 이상의 시력호전을 보인 비율(49% vs. 7%, P=0.001 )과 세 줄 이상의 시력호전을 보인 비율(32% vs. 4%, P=0.004)도 유의한 차이를 보였다[33]. 국내 연구자들에 의한 보고에서도 고위험 증식당뇨망막병증 환자들을 대상으로 범망막광응고 단독치료와 bevacizumab과의 병합치료의 효과를 비교하였을 때 병합치료군에서 시력, 황반두께 모두 유의하게 호전되었으며 유리체출혈의 발생률 역시 감소한 것으로 나타났다[34]. 또한 레이저치료의 보조요법으로 bevacizumab과 triamcinolone의 효과를 연구한 보고에서도 두 약제 모두 범망막광응고로 인한 황반부종의 악화와 시력상실의 위험을 감소시키는 것으로 확인되었다[35].
당뇨황반부종 치료에 있어서 VEGF 억제제 유리체강 내 주사요법의 효과와 안전성은 대부분 ranibizumab을 이용한 대규모 임상시험을 통해 확인되었다. 여러 차례의 대규모 전향적 무작위배정 임상시험에서 ranibizumab은 위약뿐만 아니라 기존의 표준치료법으로 시행되었던 레이저치료에 비하여서도 우수한 치료결과를 나타내었으며, 또한 위약 및 레이저치료와 유사한 안전성이 확인되어 현재는 국내에서도 당뇨황반부종의 치료에 허가를 획득한 상태이다[36373839].
Aflibercept 역시 221명의 당뇨황반부종 환자들을 대상으로한 2상 임상시험에서 레이저치료와 비교하였을 때 더 우수한 시력호전을 보였고, 현재 aflibercept를 당뇨황반부종의 치료에 적용하는 많은 대규모 임상시험들이 진행 중이다[40].
4. 유리체절제술
고전적인 범망막광응고와 국소레이저치료, 그리고 이후 도입된 유리체강 내 약물주사 및 이들의 병합요법 등을 통하여 당뇨망막병증의 치료에 많은 진전이 있었으나, 그럼에도 불구하고 일부 환자들에서는 당뇨망막병증과 당뇨황반부종으로 인한 시력상실을 막기 위하여 유리체절제술(pars plana vitrectomy)을 필요로 하게 된다. Diabetes Retinopathy Vitrectomy Study는 심한 유리체출혈이 발생한 환자에서 1년 까지 기다린 후 시행하는 지연수술에 비하여 조기수술의 이득이 더 큰 것으로 보고하였으며, 이러한 출혈 외에도 섬유혈관증식(fibrovascular proliferation)과 이로 인한 견인망막박리(tractional retinal detachment)가 있을 때 에는 유리체절제술을 시행한다(Figure 3) [4142]. 레이저나 약물치료에 반응하지 않는 당뇨황반부종이 있을 때에도 수술적 치료가 고려되며, 특히 황반부에 작용하는 견인력이 있는 것이 확인될 경우 유리체절제술의 적응증이 된다. 최근에는 유리체절제술 기계 및 도구의 기술적 발달에 따라 결막을 절개하지 않고 25-gauge 또는 23-gauge 크기의 작은 절개창을 통해 수술을 시행할 수 있어, 수술에 동반되는 손상과 수술 후 불편감을 최소화하게 되었으며 회복기간도 단축되었다.
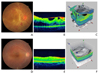
(A) Fundus photograph (FP) of the right eye shows fibrovascular membrane associated with traction retinal detachment. (B) Optical coherence tomography (OCT) clearly demonstrates traction membrane and retinal detachment over macular area. (C) Three dimensional (3D) OCT also reveals fibrovascular membrane and associated traction retinal detachment. (D) After pars plana vitrectomy, FP shows flattened retina with removal of fibrovascular membrane. (E) OCT shows restoration of normal contour of fovea with mild macular edema. (F) 3D OCT also confirms removal of fibrovascular membrane and attached retina.
당뇨망막병증의 유리체절제술에서 bevacizumab 등의 VEGF 억제제를 수술 전후에 주사하는 보조요법도 많이 사용되고 있는데, 수술 전 7일 이내에 VEGF 억제제를 유리체강 내 주사함으로써 수술 중 출혈을 감소시키고 수술 시간을 단축할 수 있는 것은 물론 수술 후에 발생하는 출혈의 위험도 낮추어 최종적인 시력예후에도 도움이 되는 것으로 밝혀졌다[4344]. 또한 bevacizumab이나 triamcinolone을 유리체절제술 종료 시 부가적으로 안구 내 주사하였을 때 두 약제 모두에서 수술 후 출혈의 발생률을 유의하게 낮추는 것으로 국내 연구자들에 의해 보고되었다[45].
유리체절제술과 관련된 가장 최근의 발전은 기계적으로 유리체를 제거하지 않고 유리체강 내로 주입한 약물에 의해 유리체가 액화, 희석되고 후유리체 박리가 유발되도록 하는 효소 유리체용해술(enzymatic vitreolysis)이다[46]. 이러한 약제의 작용을 당뇨망막병증에 적용함으로써 유리체출혈의 자연흡수를 도모하고, 후유리체 박리를 유발하여 당뇨황반부종의 회복과 증식당뇨망막병증에서 유리체절제술의 술기를 용이하게 할 수 있을 가능성이 있어 이에 대한 추가적인 연구가 진행 중이다[47].
결론
당뇨망막병증은 문명화된 국가들에서 실명의 주요 원인이며, 특히 노동연령대에서의 시력상실에 큰 영향을 미친다. 과거보다 당뇨병 환자들의 혈당조절이 향상되고 당뇨망막병증의 위험성에 대한 인식의 증가로 적절한 정기검진 및 조기진단이 이루어지며 당뇨망막병증의 급격한 진행과 이로 인한 심각한 시력상실은 감소하는 추세이다. 또한 집중치료를 통한 엄격한 혈당조절과 고혈압 및 이상지질혈증 등의 동반된 질환들을 치료하는 예방적 관리를 통해 많은 환자들에서 당뇨망막병증의 진행을 억제할 수 있게 되었으나, 이러한 치료만으로 당뇨병 환자에서 발생하는 시력저하를 모두 예방할 수는 없다. 최근 당뇨망막병증과 당뇨황반부종의 병태생리에 대한 이해가 깊어지고, 진단검사 및 치료장비의 기술적 향상이 이루어짐에 따라 당뇨망막병증과 당뇨황반부종의 치료 역시 비약적으로 발전하게 되었다. 1980년대 이후 당뇨망막병증의 치료에 적용되어오던 레이저 광응고술 및 유리체절제술에 더하여 다양한 스테로이드 제제의 사용이 확대되었으며, 특히 당뇨황반부종 및 일부 증식당뇨망막병증의 치료에 VEGF 억제제의 사용이 도입됨에 따라 당뇨망막병증의 치료에 획기적 진전이 이루어졌다. 더불어 tumor necrosis factor-α를 포함하여 현재 개발 중이거나 다른 망막질환의 치료에 사용중인 약물들을 당뇨망막병증의 치료에 적용하려는 시도들도 향후 당뇨병 환자의 시력상실을 막는데 도움을 줄 수 있을 것으로 기대된다.
Peer Reviewers' Commentary
본 논문은 당뇨망막병증에 대한 기본적인 임상소견과 더불어 내과적예방 관리 및 안과적 치료 방법을 기술한 논문이다. 당뇨망막병증은 실명의 가장 대표적 원인이 되는 질환으로 당뇨망막병증 진행을 예방하고 치료하기 위한 수많은 연구가 진행 중에 있다. 이 논문은 당뇨망막병증 치료의 이론적 근거가 되고 있는 초창기 연구 결과부터 최신의 연구 결과까지 일목요연하게 체계적으로 정리하였다. 그리하여 당뇨망막병증을 일차적으로 치료하는 안과 의사뿐만 아니라 당뇨합병증을 관리하는 의사들도 다양한 임상 연구 결과들을 체계적으로 이해하고, 그 효과를 실용적인 측면에서 사용토록 하는데 이 논문의 값진 의의가 있다 하겠다.
[정리: 편집위원회]

