조기 위암의 내시경 치료 후 불완전 절제 시의 대책
Therapeutic approach to non-curative resection after endoscopic treatment in early gastric cancer
Article information
Trans Abstract
Background
Endoscopic resection is indicated for early or superficial gastrointestinal neoplasms with a negligible risk of lymph node metastasis. This procedure could preserve the organ while allowing en bloc resection of tumors, irrespective of the size and location of the lesion. Histological evaluation of the resected specimen determines whether curative resection, which implies a favorable long-term outcome, was achieved. If the resected specimen reveals non-curative, additional treatment is necessary as it is strongly associated with recurrence.
Current Concepts
Surgical resection is recommended after non-curative resection of gastrointestinal neoplasms. However, rather than surgical resection, additional endoscopic treatment can be recommended if non-curative resection is solely because of the positive involvement at the horizontal resection margin without any other findings compatible with the non-curative resection criteria.
Discussion and Conclusion
Adopting precise indications of endoscopic resection is important to reduce the risk of non-curative resection. If curative resection is not achieved after endoscopic resection, additional treatment should be considered to prevent local recurrence as well as lymph node metastasis.
서론
내시경 절제술은 조기 위장관 신생물의 치료를 위한 최소 침습 시술로, 위장관 장벽의 점막하 부위에 용액을 주입하여 병변을 거상시킨 후 올가미 등의 내시경 절제 도구를 사용하여 병변을 포집하고, 고주파 전류발생장치를 사용하여 병변을 절제하는 방식(내시경 점막 절제술, endoscopic mucosal resection)으로 시작되었다[1,2]. 내시경 점막하 박리절제술(endoscopic submucosal dissection, ESD)은 내시경 점막 절제술과 마찬가지로 병변을 거상시킨 후 내시경 절개도를 사용하여 병변의 경계 점막을 절개(circumferential mucosal incision)하고 점막하층을 박리(submucosal dissection)하여 위장관 암이나 전암 병변을 절제하는 시술이다.
조기 위암(early gastric cancer)의 표준치료는 전통적으로 위 절제술 및 림프절 절제술(gastrectomy with lymph node dissection)이었다[3,4]. 내시경적 절제술은 림프절 전이(lymph node metastasis)의 위험이 낮은 병변을 대상으로 시행되어 왔으며, 수술과 차이 없는 우수한 치료 성적이 여러 연구를 통해 보고되었다[1,2,5-8]. 이에 따라 ESD는 조기 또는 표재성 위장관 신생물에 대한 표준치료로 자리잡았으며, 병변이 발생한 장기를 보존하면서도 병변의 일괄 절제(en bloc resection)가 가능하다는 장점이 있다[9-11]. 내시경 술기 및 기구의 발전으로 병변의 크기, 위치, 점막하 섬유화(submucosal fibrosis) 여부에 관계 없이 병변을 절제할 수 있게 되었으나 모든 표재성 신생물에 대해 내시경 절제술을 적용할 수 있는 것은 아니다[12]. 특히 내시경 절제술은 림프절 절제를 포함하지 않기 때문에, 림프절 전이나 원격 전이의 가능성이 없거나 매우 낮은 병변에 대해서 선별적으로 시행해야 한다. 따라서 시술 전 병변의 범위와 형태학적 특성, 병리학적 분화도(histological differentiation) 등을 정확히 파악하고 침윤 깊이(depth of invasion)를 예측하는 데 노력을 기울여 병변이 내시경 절제술의 대상인지 평가하는 것이 중요하다[11-13]. 또한 절제된 병변의 병리학적 검사를 통해 잔존종양(residual tumor)의 가능성 및 완전 절제(curative resection) 여부를 평가하여 추가적인 시술이나 수술이 필요한지를 확인하는 과정이 필수적이다[14].
조기 위암의 림프절 전이 여부는 수술을 통해 얻은 림프절의 병리학적 검사를 통해서만 확실한 확인이 가능하다. 림프절 전이 위험성은 병변의 병리학적 침윤 깊이와 연관이 있다고 알려져 있으나, 정확한 침윤 깊이 역시 시술 후에 절제된 병변에 대한 병리학적 검사를 통해서만 파악이 가능하다. 따라서 시술 전 병변의 형태학적인 특징이나 병리학적 특징을 바탕으로 침윤 깊이나 림프절 전이 가능성을 예측하려는 노력이 이루어졌으며, 수술 후 검체의 후향적 분석을 통해 림프절 전이의 위험요소를 파악하고자 하는 연구들이 시행되었다[13,14].
병변이 내시경 절제술 대상인지, 즉, 림프절 전이 위험이 낮은지를 판단하는 데 고려해야 할 요소에는 병리학적 분화도(histologic differentiation), 병변의 크기, 궤양 유무, 점막하 침윤 깊이, 림프혈관 침윤(lymphovascular invasion) 유무 등이 포함된다[15,16]. 하지만 ESD를 시행하기 전에 완전히 절제된 병변의 조직이 아닌 조직검사를 통해 얻은 병변의 일부 조직으로 상기 요소들을 완벽히 예측하기는 어려우며, 따라서 필연적으로 불완전 절제(non-curative resection)가 발생할 수 있다[17].
이 논문에서는 조기 위암의 내시경 절제술 후 불완전 절제로 판정되었을 때의 대책에 대해 기술하고자 한다.
완전 절제와 불완전 절제의 의미
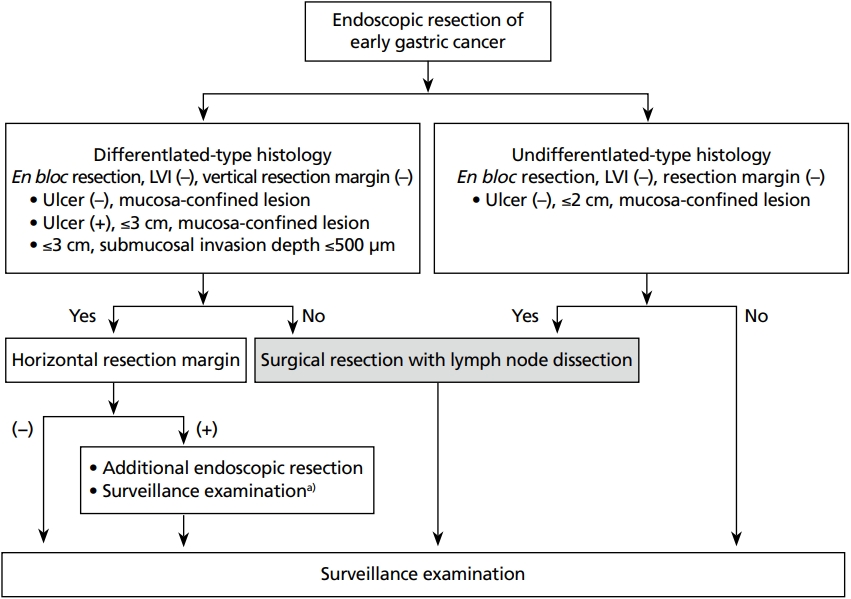
조기 위암의 내시경 절제술은 병변의 크기, 병리학적 분화도, 종양의 침윤 깊이를 바탕으로 절대 및 확대 적응증에 해당하는 경우에 시행할 수 있다. 분화형 선암(well or moderately differentiated adenocarcinoma)이고, 궤양이 없으면서 직경 2 cm 이하의 점막층에 국한된 조기 위암이 ESD의 절대 적응증(absolute indication)이다. 확대 적응증(expanded indication)에는 (1) 분화형 선암이면서 궤양이 없고 크기가 2 cm을 초과하는 점막암, (2) 분화형 선암으로 궤양이 있는 경우 크기가 3 cm 이하인 점막암, (3) 분화형 선암으로 3 cm 이하이면서 점막하 침윤 깊이가 500 µm 이내인 점막하암, (4) 궤양이 없고 크기가 2 cm 이하이면서 점막에 국한된 미분화암(poorly differentiated tubular adenocarcinoma, poorly cohesive carcinoma, signet ring cell carcinoma)이 포함된다[1,2]. 절대 및 확대 적응증에 해당하는 병변은 림프절 전이 위험이 매우 낮음이 여러 연구를 통해 보고되었고, 내시경 절제 이후 장기 생존율 역시 수술 이후의 장기 생존율과 차이가 없었다[1,2,5-8]. 다만, 위를 보존하기 때문에 ESD 후 이시성 위암(metachronous gastric cancer)을 포함하는 재발률이 수술에 비해 높으며, 이를 조기에 발견하고 치료하기 위해 시술 이후 지속적인 내시경 추적검사가 필요하다.
완전 절제는 병변이 일괄 절제되었으며 절제 후 최종 병리학적 소견에서 혈관 및 림프관 침윤이 없고, 측부 및 수직 절제경계에 종양 세포가 관찰되지 않는 경우로 정의하며, 이러한 기준을 충족하지 못한 병변은 불완전 절제로 정의한다. 시술자는 병변이 내시경 절제술의 적응증에 해당한다는 판단 하에 시술을 시행하지만 실제로는 종양의 침윤 깊이와 같은 요소를 시술 전 평가를 통해 완벽히 예측하기 어렵기 때문에 시술 이후에 절제된 병변의 병리학적 검사를 통해 완전 절제 여부를 판단하고 추가적인 시술이나 수술 여부를 결정한다.
불완전 절제 시 치료 방침
조기 위암의 내시경 절제술 후 불완전 절제로 확인되면 불완전 절제된 조직의 병리 소견을 바탕으로 잔존 종양과 림프절 전이 가능성을 평가하여 치료계획을 수립한다. ESD 후 절제된 조직의 병리검사에서 절제경계(resection margin) 양성인 경우 종양 세포가 남아 있을 가능성이 높다. 또한 조직에서 림프혈관 침윤이 관찰되는 경우 충분한 절제경계를 확보했다 하더라도 림프절 전이의 위험이 증가한다[1,2,18]. 절제경계가 음성이고 림프혈관 침윤이 없더라도 완전 절제의 기준을 벗어난 병변의 경우 림프절 전이의 위험도가 높아 추가적인 수술을 통한 림프절 절제가 필요하다[19].
국내 한 연구에서 ESD 후 불완전 절제 이유에 따라 환자를 다음과 같이 나누어 분석해 보았을 때, 절제경계가 양성이지만 이외의 완전 절제 기준은 만족시키는 경우(group 1) 또는 절제경계가 음성이지만 이외의 나머지 완전 절제의 기준을 벗어난 경우(group 2)와 비교하여 절제경계가 양성이면서 완전 절제의 기준도 벗어난 경우(group 3)와 절제경계에 상관없이 림프혈관 침윤이 관찰되는 경우(group 4) 국소 재발(local recurrence)이 흔히 발생했다[20]. 림프혈관 침윤은 내시경 육안 소견만으로는 예측이 어렵기 때문에 ESD 적응증 여부 판단을 위해 고려하는 이외 요소인 병변의 크기, 병리학적 분화도, 침윤 깊이 등을 시술 전에 정확히 예측하려는 노력이 중요하다.
한편, 일괄 절제된 분화형 선암에서 수평 절제경계만 양성이면서 다른 완전 절제의 요건은 충족한 경우에 림프절 전이의 위험성은 매우 낮다[21,22]. 이런 경우를 추가적인 치료 없이 장기 추적한 코호트 연구에서 낮은 재발률을 보였으며 재발하더라도 위암 관련 사망(cancer-related death) 없이 완치가 가능하였다[13,14]. 또한 절제경계의 일부에서 종양 세포가 발견되더라도 절제 과정 중의 화상 효과(burn effect), 응고 효과(cautery effect) 등으로 실제 잔존 위에는 종양이 남아 있지 않은 경우도 있을 수 있다. 따라서 수평 절제경계만 양성인 경우에는 추가적인 내시경 절제술이나 아르곤플라즈마 응고술(argon plasma coagulation)을 이용한 내시경 응고소작술을 시행해볼 수 있다[1,2,20,23]. 그러나 일부 연구에서 종양이 포함된 측부 절제경계의 길이가 6 mm 이상인 경우 잔류 종양 및 국소 재발 위험이 높은 것으로 보고하였으며[24,25], 소작술의 경우 절제 조직을 바탕으로 한 병리학적 평가 및 완전 절제 여부 평가가 불가능하므로 치료 대상을 잘 선별해야 하며 시술 후 면밀한 추적 관찰이 필요하다[26,27]. 추가적인 내시경 절제술 시 점막하 섬유화로 인하여 일괄 절제가 되지 않거나 절제 후 병리검사에서 절제경계에 종양이 남아 있는 경우, 또는 점막하 침윤 또는 림프혈관 침윤이 관찰되는 경우에는 수술이 필요하다.
불완전 절제의 이유 중에서 수평 절제경계 양성 이외 다른 불완전 절제의 기준에 해당하는 경우 림프절 전이의 빈도는 분화형 선암인 경우 2.6-3.0%, 미분화형 선암에서는 5-20% 이상으로 보고되었다[1,2,13,14,28]. 후향적 코호트 연구에서 림프혈관 침윤이 있는 경우 림프절 전이의 위험도가 가장 높았고 이외에도 병변의 크기가 큰 경우, 수직 절제 경계 양성인 경우, 500 μm를 초과하는 점막하 침윤을 보이는 경우 림프절 전이 위험이 높았다[13,29-32]. 이와 같이 내시경 절제술 후 림프혈관 침윤이 관찰되거나 완전 절제의 기준을 벗어나는 경우에는 추가적인 위 절제술 및 림프절 절제술을 권고한다(Figure 1).
결론
내시경 술기의 발전으로 과거 내시경 종양 절제술의 제한점으로 여겼던 병변의 크기, 위치, 점막하 섬유화 등 여러 제한점들이 극복되고 있다. 그러나 내시경 절제술은 림프절 절제를 포함하지 않는 치료방법으로, 림프절 전이의 위험성이 없거나 매우 낮은 병변만을 선별하여 시술을 결정해야 한다. 따라서 시술 전 정확한 평가를 통해 병변이 내시경 절제술의 절대 및 확대 적응증에 해당하는지를 확인해야 하며, ESD의 적응증에 해당하는 요소들을 육안 소견만으로 완벽하게 예측하기는 어렵기 때문에 불완전 절제 가능성이 있음을 숙지해야 한다. 시술 후 병리검사를 통해 최종적으로 불완전 절제로 확인되었다면 병리검사 소견을 바탕으로 림프절 전이 가능성을 평가하여 추가적인 수술이나 시술을 고려해야 한다.
Notes
Conflict of Interest
No potential conflict of interest relevant to this article was reported.
References
Peer Reviewers’ Commentary
이 논문은 우리나라에서 보편화된 조기 위암에 대한 내시경 치료 시 발생할 수 있는 불완전 절제 시의 대책에 대해 완전 절제와 불완전 절제의 의미, 불완전 절제 시 치료 방침으로 나누어 최신 문헌을 토대로 정리하여 설명해 주고 있다. 내시경 술기 및 기구의 발전은 신생물의 크기, 위치, 점막하 섬유화 여부와 무관하게 절제가 가능하므로 조기 또는 표재성 위암장관 신생물에 대한 표준 치료로 자리 잡았지만 모든 조기 또는 표재성 신생물에 대해 적용할 수 있는 것은 아니다. 이 논문에서는 조기 위암의 내시경 절제술에서 림프절 또는 원격 전이의 위험성이 낮은 완전 절제와 추가적인 처치가 필요한 불완전 절제의 의미를 기존 발표된 연구 결과를 인용하여 잘 정리해 주고 있다. 또한 불완전 절제로 나타날 수 있는 임상적 상황을 구체적으로 제시하고 이에 대한 치료방침까지 잘 정리해 주고 있어 조기 위암 환자를 진료하는 임상현장에 많은 도움이 될 것으로 판단된다.
[정리: 편집위원회]