급성 허혈뇌졸중에서 재관류치료
Reperfusion therapy in acute ischemic stroke
Article information
Trans Abstract
Background
Until mid-2010, intravenous thrombolysis remains the only reperfusion therapy for acute ischemic stroke. In 2015, the five pivotal endovascular recanalization therapy (ERT) trials demonstrated that ERT improved the prognosis of acute ischemic stroke with large artery occlusion within 6 hours after onset. Currently, ERT has been established as a crucial acute ischemic stroke treatment option. The prognosis of acute ischemic stroke is known to be time-dependent. Several studies addressed that ERT expands the time window for reperfusion therapy; thereby, improving prognosis.
Current Concepts
Recent randomized clinical trials revealed that ERT improved the outcome in patients even within the late time window of up to 24 hours of stroke onset. The trials enrolled participants who had target mismatch, defined as either clinical-core or perfusion-core mismatch, which prompted an update of the national guidelines in several countries. To select the patients with stroke who were eligible for ERT, advanced imaging tools could be recommended.
Discussion and Conclusion
According to the updated ERT guidelines, stroke centers were recommended to establish an appropriate imaging protocol and strategy for patients with acute ischemic stroke who were within the late time window. Additionally, if ERT is further practiced nationally, more manpower and infrastructure for patients with stroke should be supported at the stroke center.
서론
2014년 기준 우리나라 19세 이상 성인의 뇌졸중 유병률은 1.71%이고, 매년 10만 명 이상의 환자가 발생한다. 이 중 76%가 허혈뇌졸중(ischemic stroke)이며, 나머지는 뇌 출혈의 형태로 발생하고 있다[1]. 급속도로 고령화가 진행되는 우리나라 인구구조를 고려하면 허혈뇌졸중의 유병률은 지속적으로 증가할 가능성이 높다. 이러한 암울한 전망 에도 불구하고, 지난 20여 년 동안 급성 허혈뇌졸중 환자의 진단과 치료에 대한 몇 가지 주목할 만한 발전이 있었다. 정맥내혈전용해제(intravenous recombinant tissue plasminogen activator, IV-rtPA)나 혈관내재개통치료 (endovascular recanalization therapy, ERT)와 같은 재관류치료(reperfusion therapy) 적용 확대로 급성 허혈뇌졸중 환자의 후유장애가 크게 개선되고 있다.
급성 허혈뇌졸중은 뇌동맥의 혈류가 갑자기 차단되어 뇌 조직의 산소 공급 부족으로 인해 발생한다. 혈관폐색이 상당한 시간 동안 지속되면 해당 혈관 영역의 뇌조직은 영구적인 손상을 받는다. 1분의 허혈만으로도 190만 개의 신경세포가 사멸할 수 있다는 전임상연구도 있었으며, 시간이 뇌다 (Time is brain.)라는 말을 유행시켰다[2]. 따라서 혈관폐색으로 뇌조직이 영구적인 손상을 받기 전에 혈류를 재관류시키는 치료가 매우 중요하다. 재관류치료를 고려할 때, 중요한 개념이 허혈반음영(ischemic penumbra)이다. 뇌의 기능 저하를 유발할 정도로 심한 저관류 상태이지만, 완전한 뇌경색으로 진행되기 전에 적절한 시간 안에 혈류가 회복되면 되살아날 수 있는 뇌 영역을 의미한다. 뇌조직의 생존력은 허혈의 지속시간과 정도에 따라 달라지는데, 혈관폐색의 위치(큰 혈관폐색일수록 허혈이 심함)와 곁 순환(collateral flow)의 정도가 중요하 다. 곁순환이 양호할수록 허혈반음영이 완전한 뇌경색으로 진행하는 시간이 느리고, 재관류치료의 효과를 기대할 수 있는 치료가능시간(time window)이 더 길어진다[3].
허혈뇌졸중 재관류치료의 적응증을 고려할 때 가장 우선시해왔던 것은 치료 가능시간이었다. 혈관폐색의 시간이 길어지면, 허혈반음영이 결국 영구적인 뇌 손상(infarct core)로 진행되어, 혈관재개통의 효과를 기대할 수 없게 된다. 따라서 IV-rtPA는 증상 발생 후 4.5시간 이내에 치료를 해야 하며[4,5], ERT는 6시간 이내 치료 시작을 권장한다[6]. 그러나 곁순환의 정도에 따라 고식적인 치료가능시간 이후에도 상당기간 동안 허혈반음영이 존재할 수 있고, 따라서 재관류치료의 적응증과 치료가능시간이 점차 확대되어 왔다.
이 논문에서는 급성 허혈뇌졸중 치료에 중요한 기여를 한 임상연구들을 간략히 고찰하고, 최근 급속히 발전하고 있는 ERT를 중심으로 재관류치료의 가능시간을 확대하기 위한 연구들을 소개하고자 한다.
정맥내혈전용해제 치료
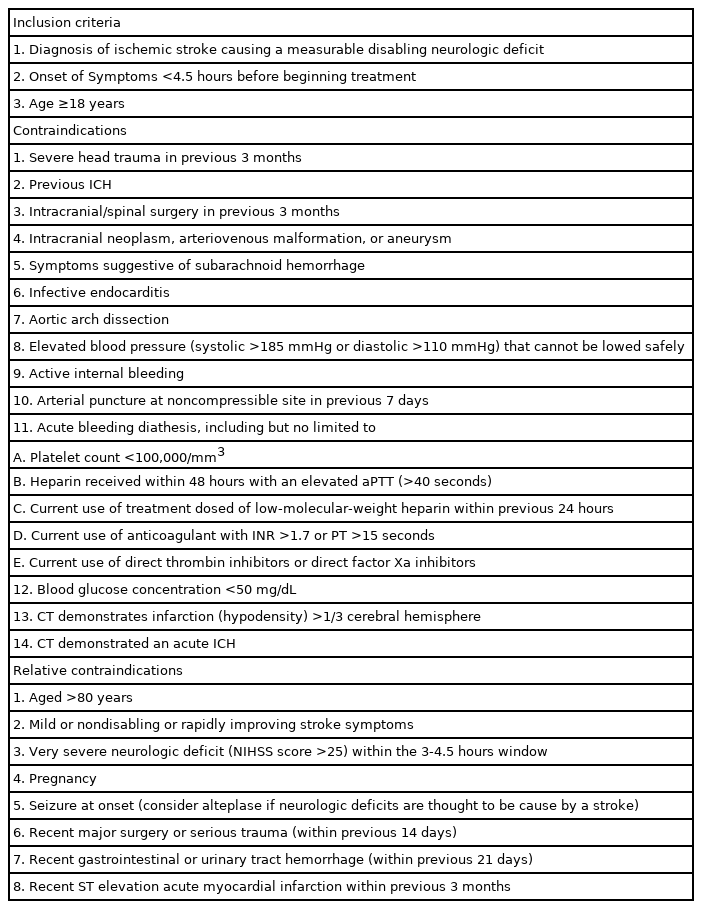
재조합조직플라스미노겐활성제(rtPA)는 1995년에 발표된 National Institute of Neurologic Diseases and Stroke (NINDS) 임상시험으로, 급성 허혈뇌졸중에서 효과가 입증된 정맥내혈전용해제이다. NINDS 연구에 의하면, 3시간 내에 치료를 하면 위약 대비 90일 후에 양호한 예후를 보일 확률을 최소 30% 높일 수 있다. 이러한 효과는 IV-rtPA 치료로 발생할 수 있는 증상뇌출혈의 증가(6.4%)를 포함한 것이다. 3시간이라는 재관류치료 가능시간은 2004년 ECASSIII 연구에 의해 4.5시간으로 확장된다. 현재의 국내 뇌졸중학회 진료지침에서 제시하는 IV-rtPA의 적응증은 Table 1과 같다.
재관류지료의 치료가능시간을 확인할 때, 증상 발생시 간은 처음으로 증상이 확인된 시간(first abnormal time, FAT)을 기준으로 하지 않고 최종적으로 정상이었던 시간 (last normal time, LNT)을 기준으로 한다. FAT와 LNT가 일치하는 경우가 많으나, 상당수의 환자들은 일치하지 않는 문제가 있다. 예를 들어, 아침 기상 시 발견된 경우(wake-up stroke)가 있다. 전날 밤 10시에 정상적으로 잠자리에 들어 아침 6시에 편마비로 발견된 경우, LNT는 전날 밤 10시, FAT는 아침 6시이다. 이 경우 환자가 7시에 응급실에 왔어도, LNT 기준으로 IV-rtPA의 고식적인 치료가능시간 4.5시간을 넘겼다고 평가한다. 그러나 이 환자의 실제 발병 시간은 아침 6시 바로 직전일 수도 있다. 이런 경우, 절대적인 시간이 아니라 허혈반음영의 존재를 추정하여 재관류 치료의 대상을 넓히기 위한 연구들이 있어 왔다. 허혈반음영의 존재를 추정하는 방법 중에 확산강조영상(diffusion-weighted image, DWI)과 액체감쇠역전회복영상(fluid-attenuated inversion recovery image, FLAIR)의 불일치를 이용하는 방법이 있다. DWI에는 병변이 보이지만 FLAIR 에서는 보이지 않는다면 그만큼 허혈반음영이 존재한다고 판단할 수 있다. 기상 시 뇌졸중으로 DWI-FLAIR 불일치가 있는 환자들에게 IV-rtPA의 효과를 입증한 WAKE-UP 연구가 있었다[7]. 또한, LNT 기준으로 4.5-9시간 경과한 환자들을 대상으로 자기공명영상이나 컴퓨터단층촬영 (computed tomography, CT) 관류영상으로 허혈반음영을 평가하여 IV-rtPA의 효과를 입증한 Extending the Time for Thrombolysis in Emergency Neurological Deficits (EXTEND) 연구도 있었다[8]. 이러한 연구를 근거로, 2019년 American Heart Association/American Stroke Association (AHA/ASA) 뇌졸중 진료지침에서는 기상 시 뇌졸중이나 불명확한 발병시간으로 LNT 기준으로 4.5시간을 초과하여도 DWI-FLAIR 불일치나 관류영상을 활용하여 허혈반음영을 추정하여 선택적으로 IV-rtPA를 사용할 수 있다고 하였다(근거수준 2) [9].
rtPA는 0.9 mg/kg의 용량(최대 용량 90 mg) 중 10%는 1분에 걸쳐 정맥 내 주사하며, 나머지는 1시간에 걸쳐 투여하는 것이 표준적인 방법이다.
스텐트혈전제거기를 이용한 혈관내재개통치료의 무작위대조시험
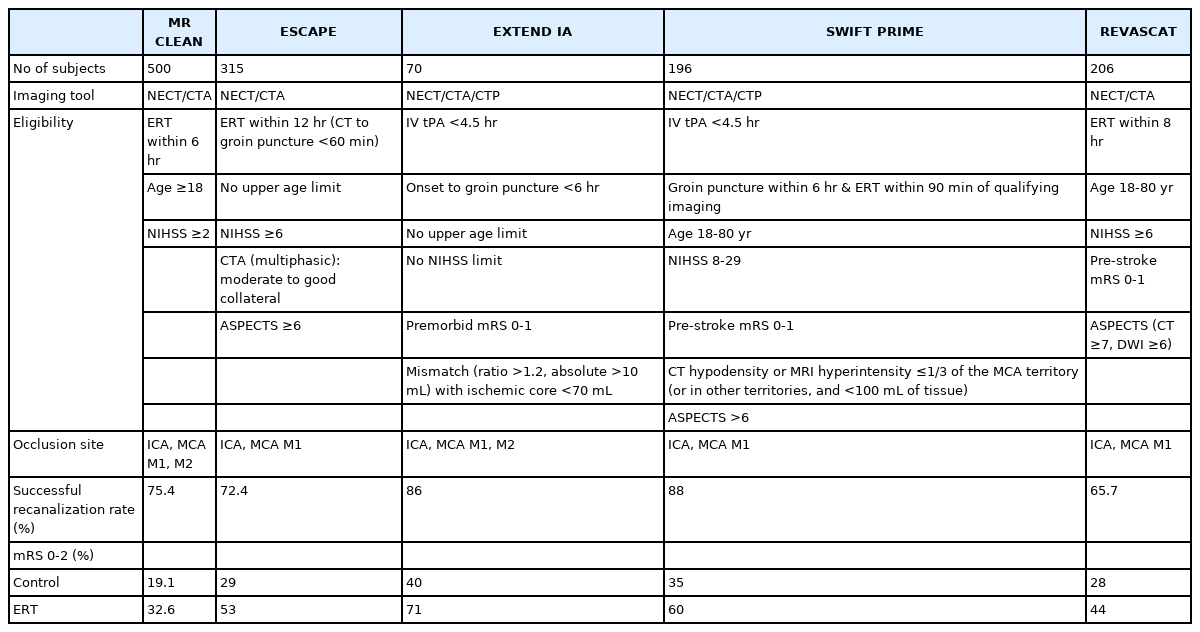
큰 혈관의 폐색에 의한 급성 허혈뇌졸중 환자는 신경학적 결손 정도가 매우 심하여, 폐색된 혈관의 재개통은 환자의 예후에 가장 중요한 영향을 미치는 요인이다[10]. 2014년까지 치료 효과가 입증된 유일한 치료는 IV-rtPA였으나, 적응증이 극히 제한되며 큰동맥폐색(large artery occlusion) 에서는 상대적으로 낮은 재개통 성공률을 보인다[11]. 이런 이유로 두개 내 폐색혈관까지 직접 카테터를 통해 혈전용해제를 투여하여 혈전을 녹이거나 기구를 이용하여 혈전을 기계적으로 제거하는 ERT가 좋은 효과를 보일 것을 기대하였으나, 초기 2013년 무작위대조시험에서는 IV-rtPA 단독치료보다 우월한 효과를 입증하지 못하였다[12-14]. 그 이유는 적절한 환자군을 선별하지 못했고, 비효율적인 1세대 혈전제거기구를 사용하여 재개통 성공률이 높지 않았으며, 재개통에 성공하더라도 재개통에 소요된 시간이 길었고, 두개내출혈 같은 합병증이 높았기 때문이다. 그러나 이후 새롭게 개발된 2세대 혈전제거기구인 스텐트혈전제거기(stent retriever)를 이용하여 2015년 5개의 대규모 무작위대조시험이 진행되었고, 그 연구 모두에서 ERT가 IV-rtPA보다 환자의 예후 개선에 우월한 결과를 입증하여, 현재는 국내뿐만 아니라 전 세계적으로 급성 허혈뇌졸중의 필수적인 치료로 권고되고 있다(Table 2) [15-19].
위 5개의 연구들이 성공한 공통적인 요인을 분석해보면, (1) CT나 자기공명영상으로 뇌혈관영상검사를 신속하게 시행하여 ERT에 적절한 환자를 선택하였고, (2) 1세대 혈전제거기구에 비해 효과적이고 안전하다고 증명된 2세대 혈전제거기구인 스텐트혈전제거기를 사용하였으며, (3) 환자 도착 후 ERT 시행까지의 시간을 효과적으로 단축시켰기 때문으로 분석된다.
그리하여 2015년 AHA/ASA 진료지침은 위 연구를 기반으로, 다음과 같은 환자에서 스텐트혈전제거기를 이용한 ERT를 높은 근거수준으로 권고하고 있다. (1) 발병 전 수정 Rankin 척도(modified Rankin Scale, mRS) 0-1점, (2) 내경동맥 또는 중대뇌동맥의 M1 분절의 폐색, (3) 18세 이상, (4) 미국국립보건원뇌졸중척도(National Institute of Health Stroke Scale) 6점 이상의 신경학적 중증도, (5) Alberta Stroke Program Early CT Score (ASPECT) 점수 6점 이상, 그리고 (6) 증상 발생 6시간 이내에 ERT를 시행할 수 있는 환자[6].
2016년 국내에서 개정된 치료지침에서도 2015년 AHA/ASA 진료지침과 마찬가지로 6시간 이내에 ERT를 높은 근거수준으로 권고하고 있고, 일단 ERT 적응증이 확인되면 가능한 빨리 치료를 시행하며, 스텐트혈전제거기를 이용을 우선적으로 권고하고 있다. 한편 증상 발생 6시간이 지난 환자의 치료에 대해서는 국내의 진료지침에서는 근거수준은 낮으나 다중기법영상을 이용하여 임상적으로 환자에게 예상되는 이득과 안정성을 평가한 후 ERT의 효과가 있다고 기대할 수 있는 환자에서 고려하도록 하고 있다[20].
증상 발생 후 혈관내재개통의 치료가능시간을 연장하기 위한 노력
6시간 이내에 시행된 ERT를 받은 1,287명의 환자들의 개별 데이터를 대상으로 한 메타분석에서는 재개통이 1시간 지연될수록 약 6.7%씩 신경학적 증상이 악화되며 3개월 후 기능적으로 독립적인 활동을 보일 가능성이 5.2%씩 감소하는 것으로 나타났다. 이 연구에서는 ERT의 치료가능시간을 증상 발생 후 7.3시간으로 제시하였으며, 빠른 재개통이 환자의 예후를 결정하는데 결정적임을 강조하였다[21].
하지만 실제 임상에서 상당한 시간이 지났더라도 ERT를 시행하여 좋은 결과를 보인다는 소규모 연구결과들이 있었고, 6시간이 지나서도 병변이 계속 진행하는 환자들도 있기 때문에 6시간이라는 기준을 일률적으로 적용해서는 안된다는 의견이 있었다. 한 연구에서는 증상 발생 후 8시간이 지났지만, 다중기법영상을 통해 허혈반음영이 큰 환자들에게서 ERT를 시행하였을 때 환자의 예후가 유의하게 개선된 결과를 보고하였다[22]. 또한 뇌관류영상으로 ERT의 효과를 연구한 Endovascular Therapy Following Imaging Evaluation for Ischemic Stroke (DEFUSE2) 연구에서는 관류확산불일치(perfusion-diffusion mismatch)가 뚜렷하여 표적불일치(target mismatch)를 만족하는 환자군을 분석했을 때 증상 발생으로부터 재개통까지의 시간은 환자의 예후와 관련이 없었다[23]. 즉, 관류확산불일치로 회복 가능한 뇌조직 영역이 넓은 환자를 선별하여 분석했을 때, 6시간 이내에 치료를 시행한 환자와 6시간 이후에 치료를 시행한 환자에서 3개월 후 기능적 독립(mRS 0-2점)을 보이는 경우가 59%, 54%로 유의한 차이가 나지 않았다[24]. 이는 치료까지의 시간이 길더라도 회복 가능한 뇌조직 영역이 넓다면 시간과 상관없이 좋은 예후를 보일 수 있다는 것을 의미한다. 이후, 이런 결과들을 기반으로 6시간 이후에 내원한 환자들을 대상으로 한 대규모 무작위대조시험들이 진행되었다.
뇌졸중 발생 6시간 이후의 환자들을 대상으로 한 혈관내재개통치료 연구 (DAWN, DEFUSE 3)
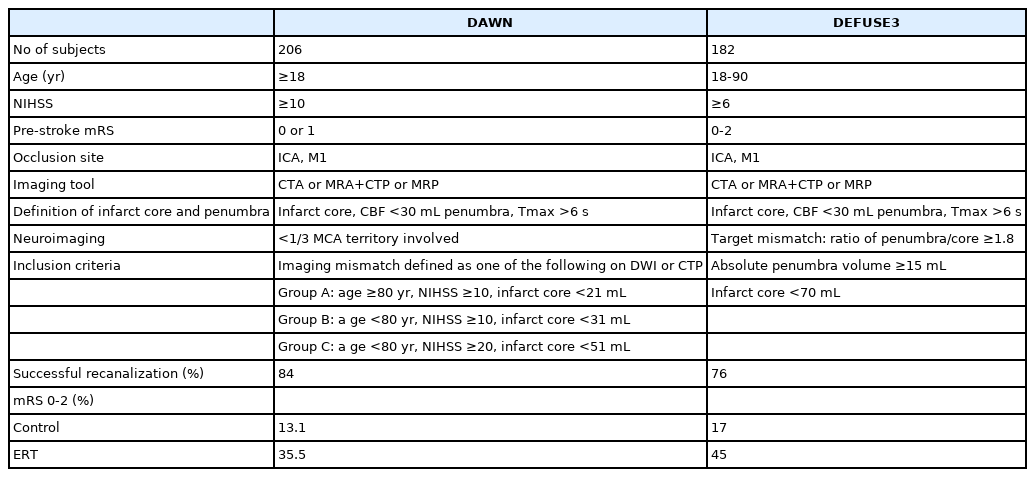
2018년 치료가능시간을 6시간 이상으로 확장한 2개의 무작위대조시험이 발표되었다. DWI or CTP Assessment with Clinical mismatch in the Triage of Wake-up and Late Presenting Strokes Undergoing Neurointervention with Trevo (DAWN) 연구에서는 LNT 확인 후 6-24시간 경과한 급성 허혈뇌졸중 환자 206명을 대상으로 뇌관류영상을 통한 표적불일치 부위의 면적, 나이, 그리고 뇌졸중의 중등도를 기준으로 환자를 선별하여 ERT의 효과를 입증하였다[25]. 또한 DEFUSE3 연구에서는 LNT 후 16시간까지 경과된 급성 허혈뇌졸중 환자 182명을 대상으로 고식적 치료 군과 비교하여 ERT의 효과와 안정성을 비교하였다[26]. 두연구에서는 표적불일치의 범위를 측정하기 위해 자동영상 처리프로그램인 RAPID 소프트웨어(iSchemaView, Menlo Park, CA, USA)를 이용하여 계산하였다(Table 3). 두 연구의 결과를 이해하기 위해서는 표적불일치에 대한 개념을 이해할 필요가 있다. 표적불일치라는 것은 환자의 초기 평가 시 CT관류영상이나 magnetic resonance (MR) 관류영상에서 현저한 혈류저하 있는 영역과 DWI에서 이미 허혈성 변화가 온 뇌경색(infarct core) 영역의 차이를 말하는 것이다. 두영역의 차이를 통해 회생 가능한 허혈반음영을 추정하는 것인데, DAWN과 DEFUSE3 연구는 ERT를 시행하기까지의 시간뿐만 아니라 영상기법을 이용하여 회생 가능한 뇌조직 (표적불일치 영역)을 치료 가능 환자 선택에 가장 중요하게 고려한 것이다.
DAWN 연구에서는 3개월 뒤 기능적 독립(mRS 0-2점) 인 비율이 49%로 대조군 13%에 비해 ERT의 우월한 효과를 입증하였다. 기존에 많은 연구에서 3개월 째 mRS 점수를 기능적 독립의 기준인 mRS 0-2점과 3-6점으로 이분 하여 분석하였던 것과는 달리 utility weighted mRS를 예후평가 지표로 채택하였는데, 이는 기존의 mRS 점수에 비해 환자의 삶의 질을 가중치로 부여한 새로운 점수 체계이어서 좀 더 환자중심으로 치료의 이득을 평가할 수 있다는 이점이 있다[27]. 안정성 지표인 3개월 뇌졸중 관련 사망이나 24시간 이내 뇌출혈 발생은 두 그룹에서 유의한 차이를 보이지 않았다. 뇌졸중 발생으로부터 무작위배정 전까지 시간을 12시간으로 나눠 3개월째 기능적 독립(mRS 0-2점) 을 비교하였다. 6-12시간 이내에 배정된 환자군은 ERT군과 대조군을 비교하였을 때 각각 54%와 20%, 12-24시간 환자들은 44%와 8%로 나타나서, 시간에 따라 ERT의 효과에는 변화가 없었다. DAWN 연구에서 보이는 치료 이득은 ERT의 성공적인 재관류에 있다고 말할 수 있다. ERT군의 84% 환자에서 성공적인 재관류(modified Thrombolysis in Cerebral infarction [mTICI] grade 2b 또는 3)가 이루어졌다.
DEFUSE3 연구는 3개월 이후 mRS 0-2점 비율이 치료군 45%와 대조군 17%로 ERT의 효과를 입증하였다. 안정성 지표인 사망률은 대조군이 ERT군에 비해 더 높은 경향을 보였다(14% 대 26%, P=0.05). ERT군의 76%에서 성공적인 재관류(mTICI grade 2b 또는 3)를 보였고, 통계적으로 의미는 없지만, ERT군이 대조군에 비해 24시간째 뇌경색 크기(35 mL 대 41 mL)와 뇌경색 크기가 증가한 정도(23 mL 대 33 mL)가 작았다. 증상 발생부터 무작위배정까지 9시간을 기준으로 하위군 분석한 결과, 9시간 이내에 내원한 환자에 비해 9시간 이후에 내원한 환자들이 ERT 를 시행한 후 3개월째 mRS 0-2점 비율이 유의하게 높았다. 9-12시간의 경우 3배, 12시간 이후에 내원한 경우 12배나 높았다.
최근 연구의 임상적 의의
DAWN 연구와 DEFUSE3 연구는 허혈뇌졸중 발생 6시간 이후에 내원한 앞순환 큰동맥폐색 환자에서 임상증상과 뇌경색의 진행 정도에 따라 차이가 있거나 관류영상을 통해 표적불일치가 있는 경우, 최대 24시간까지 ERT가 고식적 치료에 비해 환자의 예후를 개선시킬 수 있음을 보여주었다. ERT의 효과는 나이, 성별, 치료 전 신경학적 결손 정도, 폐색 부위에 따라 크게 다르지 않았다. 이 두 연구는 기존의 시간 기준 치료에서 조직 기반 치료로 급성 허혈뇌졸중 치료의 개념에 혁명적인 영향을 줬다고 볼 수 있다.
기존 2015년 연구들과 비교하여 임상적으로 가장 중요한 점은 6시간 이후라도 영상 소견을 통해 적절하게 환자를 선택하여 ERT로 성공적으로 재관류가 이루어졌을 때 좋은 예후를 기대할 수 있다는 것이다. DAWN 연구에서 12시간을 기준으로 6-12시간 대 12-24시간으로 나누어 비교하였을 때 시간이 경과하더라도 ERT의 효과는 줄어 들지 않았다. 오히려 12-24시간에 ERT를 받은 경우 좋은 예후를 보일 확률이 대조군의 2.4배로, 6-12시간대의 환자의 1.8배보다 높았다. DEFUSE3 연구에서도 9시간을 기준으로 9시간 이내, 9-12시간, 12시간 이후로 나누어 ERT군과 대조군을 비교하였을 때 12시간 이후의 ERT군이 3개월째 mRS 0-2점 비율이 대조군보다 6배로 가장 높았다. 결론적으로 기존의 6시간 이내의 환자를 대상으로 하였던 ERT 연구에서는 증상 발생부터 재관류까지 시간이 환자의 예후 결정에 중요한 요인이었다면, 6시간 이후 환자의 경우에는 뇌영상을 통한 표적불일치 판단이 ERT 대상 환자를 선별하고 치료 예후를 예측하는 데 더 중요하다고 볼 수 있다.
새로운 진료지침
2018년에 개정 발표된 AHA/ASA의 급성 허혈뇌졸중의 치료에 대한 진료지침에서는 DAWN 연구와 DEFUSE3 연구결과를 적극적으로 반영하여 6시간 이후의 ERT에 대한 새로운 권고사항을 제시하고 있다[28]. LNT로부터 6-16 시간 사이에 내원한 앞순환 큰동맥폐색 환자로서 DAWN과 DEFUSE3 연구의 선정기준을 충족하는 환자들에게 ERT를 높은 근거수준으로 권장하고 있다. 또한 LNT로부터 16-24 시간 이내에 내원한 앞순환 큰동맥폐색 환자로서 DAWN 연구의 선정기준을 충족하는 환자들에게 ERT가 타당함을 명시하였다. 2018년 캐나다 뇌졸중 진료지침도 두 연구의 선정기준을 따를 것을 권고한다. 대부분 병원에서 CT관류영상으로 환자를 선별하고 있는 캐나다의 진료지침은 뇌경색 부위와 허혈반음영을 측정할 수 있는 재현성 높은 소프트웨어를 사용하도록 권고하고 있다[29]. 반면 호주 진료지침은 좀 더 융통성 있는 권고안을 제시하는데, 임상증상과 CT관류영상 또는 MR 관류영상으로 평가하여 회생 가능 뇌조직이 있다고 판단하는 경우에는 LNT 기준 6-24시간 사이 환자에게 ERT를 권고하고 있다[30].
실제 의료 현장에서도 6시간 이후 시간대 환자에서 표적불 일치를 평가할 때 DAWN과 DEFUSE3 임상시험에서 검증된 RAPID 소프트웨어를 이용하는 것이 바람직할 것이다. 그러나 국내의 경우 대부분의 뇌졸중센터가 RAPID 소프트웨어를 사용할 수 없기 때문에 국내의 실정에 맞는 영상 또는 임상적 기준을 정할 필요가 있다. 뇌졸중 전문가라 할지라도 자동화 소프트웨어를 이용하지 않고 다중기법영상과 임상적 정보만 으로 ERT에 적합한 환자를 선별할 수 있는가에 대해서는 논란이 있다. DEFUSE3 연구의 토대를 마련한 사전 임상시험에서 연구자들은 RAPID 소프트웨어를 이용한 CT관류영상 분석의 정확도를 검증하기 위해 다기관 코호트연구를 수행하였다. 각 기관의 연구자들은 RAPID 소프트웨어를 사용하지 않고 각 병원의 CT관류영상 자료를 갖고 ERT 시행 여부를 결정하였다. 이 연구에서 뇌졸중 전문가가 자동화 소프트웨어를 사용하지 않고서도 임상증상과 다중기법영상 자료를 이용하여 연장된 시간대에서 표적불일치를 가진 환자를 잘 선별할 수 있음을 보여 주었다[31]. 이를 바탕으로 2019년 개정된 국내 ERT 진료지침에서는 기존의 2016년 진료지침의 항목에 “LNT 기준 6-24시간 이내 내원한 앞순환 큰동맥폐색 환자중 다중기법뇌영상 또는 신경학적 결손 평가 후 재관류로 예후를 호전시킬 수 있다고 판단되는 경우, 즉 표적불일치가 있어 재관류가 예후를 호전시킬 수 있다고 판단되는 경우, ERT 를 권고한다(근거수준 III, 권고수준 C)”라는 항목을 추가하였다. 개정된 진료지침을 기반으로 ERT를 시행하는 센터에서는 다중기법영상인 뇌관류영상(CT/MR perfusion imaging) 과 다중시기 CT 혈관조영술(multi-phase CT angiography) 을 시행할 수 있는 시스템과 신속하게 환자를 선별할 수 있는 자체 프로토콜을 마련할 것을 권장하고 있다[30].
국내 혈관내재개통치료의 현황
대한뇌졸중학회의 다기관 전향적 뇌졸중 레지스트리인 한국뇌졸중등록사업 자료에 따르면 2014년부터 2018년까지 등록된 3만 9,291명의 환자 중 7.3%가 ERT를 받았다. 추이를 보면 2014년 6.3%에서 2018년 9.8%로 급속히 증가했다. 다른 한국뇌졸중등록사업 참여병원 환자들을 분석한 2018년 연구에서는 6-24시간 사이에 내원하여 ERT의 대상이 되는 환자는 31.8%였고, 이중에서 DAWN 연구의 선정기준을 만족하는 환자는 1.1%로 보고되었다. 저자들은 이를 국내 뇌경색 발병률을 고려하면 연간 2만 7,477명의 환자가 ERT 의 잠재적 대상이고 이중 1,331명의 환자가 DAWN 선정기준을 만족한다고 설명했다. 또한 2017년 국민건강보험 청구 자료에 의하면 1년에 약 3,500명의 환자가 ERT를 받은 것으로 추정되며 ERT 시간대를 24시간까지 확장하면 ERT 대상 환자수는 약 38% 정도로 증가할 것이라고 한다. 또한 연장된 시간대까지 ERT 대상 환자를 선별하기 위해 전체 급성 뇌경색 환자 중 응급으로 스크리닝이 필요한 환자 비율이 43.9%에서 67.6%로 약 24%가 증가한다[32]. 이렇듯 2019년 개정된 국내 뇌졸중 진료지침으로 6시간 이후에 내원하여 치료 가능한 뇌조직이 남아있는 환자를 대상으로 하는 선별적 ERT의 시행률은 계속 증가할 것이다.
결론
ERT 치료의 성공적인 연구결과로 급성 허혈뇌졸중의 재관류치료는 IV-rtPA에서 한 단계 더 발전하였다. 치료가능 시간에서 치료 가능 조직으로 급성 허혈뇌졸중 치료 기준의 패러다임이 바뀌고 있다. 그러나 ERT 치료가능시간대를 24시간까지 연장하는 것은 뇌졸중 시스템에 중대한 영향을 끼칠 것으로 예상된다. 앞으로 ERT가 계속 확대 시행된다면 뇌졸중 전문의료진의 업무부담이 상당히 증가할 것으로 예상되며, 따라서 ERT가 가능한 뇌졸중센터에 더 많은 인력과 시설 지원이 뒷받침되어야 한다. 현실적으로 ERT를 하기 위해서 항시 응급으로 혈관조영술을 할 수 있는 시설과 인력을 유지하는 것은 모든 병원에서 가능하지 않다. 따라서 효율적인 급성 허혈뇌졸중 치료를 위해 병원 이송체계를 국가적으로 개선할 필요가 있다. 지역사회 및 지역병원과 ERT가 가능한 뇌졸중센터 사이에 신속한 이송체계 및 유기적인 협력이 필요하다. 이를 위해 정부의 시설 및 인적 지원 정책 수립이 뒷받침되어야 한다.
Notes
Conflict of Interest
No potential conflict of interest relevant to this article was reported.
References
Peer Reviewers’ Commentary
이 논문은 급성 허혈뇌졸중 환자를 대상으로 한 혈관내재개통 치료의 적응증과 개정된 진료 지침에 대해 정리해서 설명해 주고 있다. 혈관내재개통 치료가 도움이 되는 환자군을 판별하는 데 있어서 기존의 시간 기준 치료에서 벗어나 회생이 가능한 뇌조직의 존재 여부를 중요시하는 조직-기반 치료가 더 중요함을 강조하고 있다. 특히 기존 제한 시간이었던 6시간을 초과한 후에 내원한 경우 뇌관류 영상과 다중시기 CT 혈관조영술과 같은 영상 기법을 이용해서 허혈반음영이 큰 경우에는 혈관내재개통 치료가 도움이 될 수 있어 치료의 적응증이 확대되고 있음을 잘 설명해 주고 있다. 또한 혈관내재개통 시술을 위한 시설 및 인력 확충, 신속한 이송체계 확립과 같은 제도적 뒷받침이 중요함을 설명하고 있다. 이 논문은 허혈뇌졸중을 진료하는 임상 현장에 많은 도움을 줄 것으로 판단된다.
[정리: 편집위원회]