 |
 |
- Search
| J Korean Med Assoc > Volume 56(9); 2013 > Article |
Abstract
Despite its proven efficacy in the treatment of atrial fibrillation (AF), the Cox-Maze III procedure has not been widely accepted owing to its complexity and technical difficulty. New ablation technologies have led to the development of various simplified lesion sets, including minimally invasive techniques. Given recent improvements in the percutaneous catheter ablation technique, it seems to have replaced surgical treatment of AF, especially for lone AF. However, suboptimal results of catheter ablation have been reported, and it has been well established that the Cox-Maze III procedure is still the gold standard for surgical AF ablation. Nevertheless, many physicians and patients are reluctant to undergo surgery for lone AF because of its invasiveness. In this regard, improvements in minimally invasive technology should be directed toward replicating the original Cox-Maze III technique and ultimately on performing it on the beating heart without cardiopulmonary bypass. This review provides an overview of the current state of the art and future directions in the surgical treatment of AF. Based on a better understanding of the mechanisms of AF and various treatment techniques, and improvements in diagnostic techniques, the appropriate option among various surgical techniques should be selected tailored to individual patients, making the surgical treatment of AF available to a larger population of patients.
심방세동은 치료를 요하는 가장 흔한 부정맥으로, 일반인구에서 약 0.4 - 1% 정도의 유병률을 보이며 연령이 증가함에 따라 남성에서 발생빈도가 증가하는 것으로 알려져있다[1]. 대규모 횡단연구에 따르면 60세 이하에서의 유병률은 높지 않으나 80세 이상에서는 8%이며 1970년대에 비해 1990년대에 남성에서 유병률이 두 배 증가하였다[2,3]. 발견되지 않은 무증상 심방세동 환자나 인구의 고령화를 고려하면 실제 유병률은 더욱 높을 것으로 추정된다.
심방세동에 따른 임상적인 문제로는 심계항진에 따른 불편감 및 심리적 불안감, 심방과 심실 간의 수축 부조화로 인한 심박출량 감소 및 좌심방 내 혈류저류에 따른 혈전생성 및 색전의 위험성 등이 있다. 뇌졸중 환자에서 6명당 한 명의 비율로 심방세동이 동반되어 있으며 심방세동 환자에서 뇌졸중의 위험이 2-7배 높고, 매년 5% 정도 뇌졸중 발생률이 증가한다[4,5].
심방세동의 치료는 크게 내과적 치료와 수술적 치료로 나뉜다. 내과적 치료는 항부정맥제, 전기쇼크를 통한 심박 전환(electrical cardioversion), 심박수 조절(rate control) 약제와 항응고제를 이용한 치료 등이며, 수술적 치료는 카테터 또는 외과적 수술을 통하여 심방의 가능한 모든 세동이 발생하도록 하는 매크로-재진입 회로(macro-rentrant circuit)를 차단하여 심방세동이 발생하지 못하게 하는 메이즈 수술(Maze procedure)을 근간으로 한다[6,7]. 최근 보고된 15년간의 메이즈 수술 성공률은 단독심방세동(stand-alone atrial fibrillation)에서 95%에 이르며 다른 심장질환에 동반된 심방세동에서 97% 정도로 보고된다. 또한 메이즈 수술 후의 혈전색전증 발생에 대한 자유도는 99.4%로 보고된다[8,9]. 2007년 Heart Rhythm Society가 제시한 심방세동의 카테터 및 수술적 치료 적응증은 Table 1과 같다[10].
메이즈 수술은 광범위한 실험실 내 연구를 거쳐 Cox 등[11]에 의해 문헌 상 소개되었다. 메이즈 수술은 심방 내에 존재 가능한 모든 매크로-재진입 회로를 차단하여 심방조동이나 심방세동을 만들어내지 못하도록 고안되었으며, 그 결과 많은 환자에서 정상 동률동(sinus rhythm)으로의 전환에 성공하였다. 심방에 미로(maze) 모양의 절개를 통해 전기전달을 차단하여 전도가 동방결절에서부터 곧바로 양쪽 심방으로 전달될 수 있도록 하였다.
처음 고안된 메이즈 수술, 즉 콕스-메이즈 I (Cox-Maze I) 수술은 1991년에 문헌 상으로 소개되었으며[12,13], 장기간 추적 관찰한 결과 합병증으로 서맥의 발생과 그로 인한 인공박동기 삽입율의 증가로 인하여 곧 콕스-메이즈 II (Cox-Maze II) 수술로 수정되었다. 하지만 콕스-메이즈 II 수술 역시 수술 절개선이 복잡하고 기술적으로 구현하기 어려운 면이 있어 다시 수정을 가해 콕스-메이즈 III (Cox-Maze III) 수술로 변모하였다(Figure 1) [13].
최근에는 콕스-메이즈 III 수술의 절개선 중 일부를 수술적 절개가 아닌 냉동 절제(cryoablation) 및 방사선 고주파 절제(radiofrequency ablation)를 이용하여 변형을 한 콕스-메이즈 IV (Cox-Maze IV) 수술이 소개되었다[14]. 메이즈 수술이 소개된 이래로 이 수술의 정상 동률동으로의 전환효과가 매우 우수하다는 것이 여러 임상연구들을 통해 밝혀져 왔고, 그에 따라 다양한 심장수술 환자에게 그 적용 범위가 확대되어왔다. 여러 문헌들에서 메이즈 수술에 따른 심박출량의 증가와 혈역학적 개선, 환자의 증상개선 등의 효과가 입증되었다[8,9,15].
빈맥(tachyarrhythmia)이 발생하고 지속하려면 시작을 일으키는 기전(initiation)과 그 상태를 유지할 해부학적인 기질(substrate)이 필요하다. 심방세동에서는 그 과정에 복합적인 기전이 관여하는데, 국소적인 부위에서 자동적으로 촉발되는 국소적 트리거(focal trigger)와 다발성 재진입 웨이블렛(multiple reentrant wavelet) 가설이 여러 자료들을 통해 뒷받침되고 있다. 심방세동의 촉발을 일으키는 국소적인 부위가 존재하며 이 부위를 전기적으로 절제(abla-tion)함으로써 심방세동을 멈추게 할 수 있다는 점이 가장 획기적인 발견이며, 이러한 발견은 심방세동의 수술적 치료에 있어서 폐정맥과 좌심방 후벽, 또한 그 부위에 있는 자율신경계에 초점을 기울이도록 하였다[16].
다발성 웨이블렛 가설(multiple wavelet hypothesis)은 1980년대 후반까지 가장 보편적으로 받아들여져 왔던 가설로, 심방세동은 양쪽 심방에서 동시에 발생하여 다발성으로 재진입하는 작은 전류 웨이블렛(multiple reentrant wavelets)으로 인해 나타난다는 것이다[17]. 전도속도의 감속, 불응기간의 단축 및 심방 조직량의 증가에 따라 심방세동이 지속되는데, 불응성(refractoriness)이 주변으로 확산됨에 따라 전기전도의 지연 및 단절이 증가되어 재진입이 촉진된다. 심방세동이 지속되려면 일정 수준 이상의 재진입 전류가 있어야 하며, 이는 해당부위에 일정량 이상의 병적인(pathologic) 심방조직이 있어야 가능하다. 메이즈 수술은 이 이론에 근거하여 만들어졌다.
Haissaguerre 등[18]은, 심방세동은 주로 국소적 진원에 의해 유발되며, 이를 제거함으로써 심방세동도 제거될 수 있음을 제시하였다. 이러한 국소적 트리거(focal triggers)들은 주로 폐정맥에서 발견되는데, 좌심방과 폐정맥이 연결되는 이행 부위, 소위 심근 소매(myocardial sleeve)라 불리는 부위이다. 이 부위에서는 좌심방의 심근섬유(myocardial muscle fiber)가 폐정맥 안으로 1-3 cm 정도 연결되며, 근위부가 가장 두꺼우며(1-1.5 mm) 원위부로 갈수록 얇아진다. 심박조율 기능(pacemaker activity)을 가진 특화된 전도조직이 심근 소매 내에 있으며, 이러한 조직의 존재가 심방세동의 트리거가 될 수 있음이 밝혀져 있다[19].
중심 자율신경계(central [extrinsic] autonomic nervous system) 또는 심장 자율신경계(intrinsic autonomic nervous system) 모두에서 심방에 자율 신경 전달을 유발할 수 있다. 심장 자율신경계는 자율 신경절 다발(autonomicganglionated plexi)이라 불리는 신경절 다발을 가지고 있는데, 심외막(epicardium)의 지방층과 마샬 인대(ligament of Marshall)에 분포하고 있다(Figure 2) [10].
심방의 근육세포와 비교하여 폐정맥의 근육세포는 활동 전위 지속시간이 짧고 자율신경 자극에 민감하다. 이는 발작성 심방세동 환자에서 폐정맥에서 일어나는 전기적 점화가 더 많이 발생하며, 이러한 자율신경절 다발을 전기적으로 절제함으로써 국소적 점화를 중단시킬 수 있다는 사실을 설명해 줄 수 있다.
자발적인 폐정맥 점화(triggered spontaneous pulmonary vein firing)는 심장 주변의 신경절의 전기자극으로도 유도 가능한데, 이는 국소적 트리거로 작용해 심방세동을 일으킬 수 있다고 보고되고 있다[20]. 이러한 연구결과는 심장 자율신경계가 폐정맥 점화를 촉진하거나 재진입을 유발하여 심방세동을 일으킬 수 있다는 증거라 할 수 있다.
심방세동의 발생에는 국소적 '트리거'와 '재진입'을 위한 심방조직의 '기질'이 모두 중요한 것으로 받아들여지고 있다. 따라서 심방세동을 수술적으로 혹은 카테터 방법으로 치료하기 위해서는, 트리거를 제거하거나 심방조직의 부정맥 기질을 변화시키거나 제거하는 것이 필요하다. 이는 폐정맥 주위를 전기적으로 고립(electrical isolation)시키거나 좌심방 후벽에 존재하는 마샬 인대를 절제하여 자율신경계 전달을 차단하는 것, 심방 벽에 전기적 절제선(ablation line)을 가함으로써 재진입을 막는 것, 그리고 기질로 작용할 수 있는 병적인 심방조직을 줄여주는 것 등이다.
현재 기준 치료법(gold standard)으로 자리잡은 콕스-메이즈 III의 최초 절개선은 "cut-and-sew" 방법, 즉 직접 심방을 가위로 절개했다가 다시 꿰매는 방식으로 그림(Figure 3A-3C)과 같은 모습이었다. 국소적 트리거가 분포하고 있는 부위에서 재진입이 발생하여 매크로 재진입 회로가 만들어지는 것을 차단하기 위하여 심방을 여러 구역으로 나누어 전기전도를 차단하며, 그 절개선은 다음과 같다.
① 좌심방: 폐정맥 주위, 좌심방이 절제, 폐정맥 주위를 차단한 선에서 좌심방이와 승모판륜에 이르는 선으로 이루어진다.
② 우심방: 상대정맥과 하대정맥을 잇는 선, 우심방이 절제, 우심방이 절제에서 앞뒤로 이어지는 선, 심방 절개선에서 삼첨판륜에 이르는 선으로 이루어진다.
③ 관상동(coronary sinus): 좌심방 절개선에서 관상동에 이르는 선을 말한다.
콕스-메이즈 III의 입증된 효과에도 불구하고 수술 자체의 복잡함과 기술적인 어려움 때문에 널리 이용되지 않았다. 그래서 수술시간을 줄이고, 수술을 좀 더 단순화할 수 있는 여러 가지 변형들이 고안되었다. 실제 가위로 절개하고 다시 꿰매는 방법 대신 여러 에너지원을 이용하여 심근 전층의 병변(transmural lesion)을 만드는 절제방법들이 고안되었다(Figure 3D-3F). 대표적인 변형이 콕스-메이즈 IV 술식으로, 양극성 방사선고주파(bipolar radio-frequency)를 이용하여 폐정맥 주위 절제선을 좌/우 따로 하는 방법이다(Figure 3F) [14].
기존의 심방을 절개한 후 다시 꿰매는 복잡한 수술방법의 번거로움을 해소하고 수술시간을 단축시키려는 노력으로 여러 에너지원을 이용한 절제방법이 고안되었으며, 냉동절제(cyroablation), 방사선 고주파(radiofrequency), 극초단파(microwave), 레이저(laser), 고강도집중 초음파(high-intensity focused ultrasound) 등이 있다. 하지만 현재 여러 데이터 결과를 통해 효과가 입증되어 보편적으로 사용하고 있는 기구는 냉동절제와 양극성(bipolar) 방사선 고주파이며, 단극성(monopolar) 방사선 고주파와 극초단파는 그 효과가 만족스럽지 않아 최근에는 거의 사용되지 않고 있다. 고강도 집중 초음파는 최소 침습 수술 기술의 발전과 더불어 각광받고 있지만 아직 그 효율성에 대한 임상 데이터가 부족한 상황이다.
이러한 새로운 대체 에너지원을 사용한 기구들 덕에 축소되고 간결화된 절제선 세트(lesion set)가 가능해졌고, 최소 침습적인 방법(minimally invasive technique)들이 발전하였다. 절제선이 실제 절개하는 것과 비슷한 효과를 얻기 위해서는 절제선이 전기전도를 완전히 차단할 수 있도록 심근 두께의 전층에 걸친 손상을 만들어야 하고(transmurality lesion), 절제기구의 안정성, 심방세동 차단을 위한 절제선 외에 불필요한 정상 구조물의 손상이 없어야 한다. 최근에는 최소 침습적인 방법 및 인공심폐기를 사용하지 않고 심장이 뛰는 상태(beating heart)에서 효율적인 심외막 절제선(epicardial lesion)을 만드는 방법이 발전하고 있어, 이를 감안하면 이상적인 대체에너지원이 갖추어야 할 조건은 다음과 같다.
심장이 뛰는 상태에서 심내막(endocardium)으로나 심외막으로 모두 완전한 심근 전층의 전도 차단(transmural lesion)이 가능할 것, 에너지에 따른 심근 손상의 정도가 정확한 용량-반응 곡선(dose-response curve) 관계일 것, 빠르고 안전하게 절제선을 만들 수 있을 것, 기구의 유연성과 조작이 편리할 것, 그리고 최소침습 절개수술에도 쓸 수 있도록 기구가 가늘고 길 것 등이다.
새로운 기구들의 발전과 더불어 최소 침습적(minimally invasive approach)이며 간단해진 수술기법들이 발전하게되었다. 문헌상으로 나와 있는 것들 중 대표적으로 크게 두 가지 방법으로 요약할 수 있다. 첫째, 기존의 콕스-메이즈 III 술식의 개념을 그대로 반영시키는 변형 방법, 둘째는 폐정맥 고립(pulmonary vein isolation) 혹은 폐정맥 고립과 함께 신경절 총 절제를 하는 단순화된 방법이다.
콕스-메이즈 III 수술은 현재 심방세동의 수술적 치료에 있어서 기준 치료법이며 카테터 절제술에 비해 그 효율성이 뛰어남이 잘 알려져 있다. 다른 판막 질환과 함께 동반으로 시행하는 심방세동 수술(concomitant surgical atrial fibrillation ablation)에 대해서는 수술적 치료가 기준 치료법임에는 이견이 없겠지만, 단독 심방세동의 치료에 있어서는 수술의 복잡성과 기술적 어려움 때문에 널리 시행되고 있지 않다. 더욱이 카테터 절제술의 발전에 따라 기존의 정중흉골절개와 같은 침습적인 방법으로 수술하는 것은 환자나 의사에게 모두 환영받지 못하게 되었다. 단독 심방세동의 정의와 수술 적응증은 다음과 같다.
•단독 심방세동: 임상적 또는 심초음파 검사를 통해 고혈압을 포함한 심폐 질환의 증거가 없는 60세 이하의 젊은 환자에서의 심방세동을 말한다.
•단독 심방세동의 수술 적응증은 다음과 같다.
- 환자가 수술적 치료를 원하는 경우 시행한다.
- 1-2회의 카테터 절제술에 실패한 경우 수술을 시행한다.
- 카테터 절제술의 적응증에 해당하지 않는 경우, 다음의 경우 수술적 치료가 선호된다.
(i) 와파린 사용이 금기이면서 뇌졸중의 위험성을 줄이기 위해 좌심방이 절제가 도움이 된다고 판단될 경우 수술이 선호된다.
(ii) 카테터 절제술이 금기이면서 좌심방이 혈전이 있는 경우 수술이 선호된다.
(iii) 좌심방 크기가 5cm 보다 큰 경우 수술이 선호된다 (상대 적응증).
지난 10년 간 심방세동의 수술적 치료는 매우 급격한 변화를 거쳐 왔다. 새로운 기술의 발전으로 인하여 인공심폐기를 사용하지 않고 심장이 뛰는 상태에서 최소 침습 방법으로 대체에너지원을 이용하여 효과적인 절제선을 만들 수 있는 단계에까지 이르렀다.
흉강경을 통하여 폐정맥 고립과 좌심방이(left atrial appendage)를 절제하는 최소 침습적인 방법이 2005년에 처음으로 소개되었다[25]. 수술과정을 간단하게 하고 수술시간을 줄이기 위하여 수술과정을 단순화시킨 방법들이 많이 개발되었지만, 결국 여러 임상결과들을 통하여 지속적인(persistent) 또는 장기간 지속적인(longstanding persistent) 심방세동에서 성공적인 동률동 전환을 위해서는 폐정맥 고립만으로는 힘들고, 좀 더 광범위한 절제선 세트가 필요함을 알 수 있었다. 결국 최소 침습적 접근법을 하더라도 좀 더 완전한 절제선 세트를 구현하기 위하여 콕스-메이즈 III를 재현하는 것이 동률동 전환의 성공 및 유지에 중요하다.
콕스-메이즈 III를 재현하기 위해서는 승모판륜(mitral annulus)을 연결하는 절제선을 만드는 것이 가장 도전적인 과제였다. 이를 뛰는 심장 상태에서 하기 위해서는 여러 문제점들이 있을 수 있는데, 첫째로 심장이 뛰는 상태에서 좌심방의 뒤쪽을 보는 것이 매우 제한적이며 둘째, 승모판륜과 인접하여 주행하는 좌측 굴절 관상 동맥(left circumflex coronary artery)의 손상 가능성, 그리고 관상동(coronary sinus)을 승모판륜의 심외막 랜드마크로 삼는데, 이 또한 정확하지 않다는 점이다[26]. 이러한 문제를 해결하기 위하여 "Dallas Lesion Set"나 "5-Box Lesion Set"같은 최소 침습 수술을 위한 새로운 변형 절제선이 고안되기도 하였다(Figure 5) [27,28].
이처럼 최소 침습적 접근법으로 되도록 콕스-메이즈 III에 가까운 결과를 얻기 위한 노력들이 이루어지고 있다. 하지만 이러한 새로운 기술로 간단해진 방법들이 과연 심방세동 환자에서 동률동을 성공적으로, 또 효과적으로 유지할 수 있는 지 여부에 대해서는 아직 무작위전향연구 결과가 없는 실정이다.
양측 흉강경 접근법(bilateral thoracoscopic approach)은 가장 널리 사용되고 있는 방법으로 양측 최소 개흉술을 통해 접근하거나 흉강경 포트만을 통해 폐정맥 고립과 좌심방이 절제, 그리고 신경절 다발을 절제하는 방법이다.
우측 흉강경 접근법(right-sided thoracoscopic approach)은 오른쪽 흉강에 두 세 개의 포트를 통하여 접근하는 방법이다. 이 접근법의 단점으로는 좌심방이를 절제하는 것이 불가능하다는 점이 있다. 하지만 Balkhy 등[29]이 흉강경 하에서 스테이플러로 좌심방이를 절제할 수 있는 기구를 소개하였다.
좌측 흉강경 접근법(left-side thoracoscopic approach)은 우측 흉강경 접근법과 비슷하나 좌류현심방이 절제와 마샬 인대의 절제선이 용이하다는 장점이 있다.
하브드리스 술식(hybrid approach)에 대한 개념은 Pak 등[30]에 의해 처음 소개되었다. 어려운 심방세동 케이스에서 경피적 심외막 카테터 절제술과 심내막 절제술을 접목시켰다. 최근에는 Krul 등[31]이 흉강경을 이용한 폐정맥 고립과 함께 시술 중 전기생리학적 검사(electrophysiologic testing) 결과를 보며 필요한 부위에 추가적으로 신경절 다발 절제술을 함께 시행함으로써 86%의 성공률을 보고하였다.
하이브리드 술식의 장점은 심낭막(pericardium)이 열린 상태이기 때문에 심방 중격 천공 (transseptal puncture) 시 심낭압전(cardiac tamponade)의 위험이 없다는 점, 수술 중 횡경막 신경이나 식도 손상의 위험성이 줄어든다는 점, 절제기구가 좌심방 내에 위치하며 방사선 마커로 표시되기 때문에 폐정맥 협착을 방지할 수 있고, 또한 대부분의 절제선이 심외막을 통해 만들어지기 때문에 혈전 색전의 위험을 줄일 수 있다는 점 등이다. 하지만 하이브리드 술식의 단점은 시술시간이 단독수술이나 시술에 비해 오래 걸린다는 점, 심방 중격 천공 후 헤파린의 사용은 수술적으로 박리한 부분에서 출혈을 일으킬 수 있다는 점이다.
승모판 수술 시 수술 전 심방세동이 환자의 임상적 결과(생존율, 주요 합병증 발생률)에 나쁜 영향을 미친다는 사실은 이미 잘 알려져 있다(Figure 6) [32]. 하지만 심장 수술 시 동반된 심방세동에 대한 적극적인 수술적 치료가 일반적으로 널리 행해지고 있지 않은 이유는 수술 과정의 복잡함, 수술 위험성의 증가, 임상적 결과에 대한 근거 부족 때문이다.
다른 심장 수술(특히 승모판막 수술) 시에 부정맥의 수술적 치료를 동반하는 것이 어떤 영향을 미치는 지에 관한 대표적인 무작위 전향적 연구 결과는 Table 3과 같다. 하지만 이 연구들의 결과에서 볼 수 있듯이, 수술 후 동률동 전환이나 동률동의 유지에 있어서는 부정맥 수술을 추가하는 것이 유리하나, 실질적으로 임상적 결과에 중요한 사망률, 뇌졸중 발생률, 출혈 관련 합병증 등에 대한 근거는 현재로써는 아직까지 부족한 실정이다. 후향적 관찰 연구에서 뇌졸중 발생이나 출혈 등의 주요 합병증, 그리고 심장기능의 호전 등에 있어서는 부정맥에 대한 적극적인 수술적 치료가 유리하다는 보고가 있으나 생존에 대한 연구는 향후 시행되어야 할 것이다[15].
Heart Rhythm Society에서 2007년에 제시한 다른 심장 수술에 동반된 부정맥 수술에 대한 적응증은 "증상이 있는 심방세동의 경우"와 "증상이 없는 심방세동 환자에서 부정맥 수술 동반에 따른 추가 수술 위험도가 최소인 경우"였다. 최근 2012년에 개정된 가이드라인에서는 증상이 있는 심방세동 환자에 대해서만, 그마저도 권고 사항 IIa 및 근거수준 C로 제시되어 있을 뿐이다(Table 1).
새로운 기구의 발전, 전기생리학적 연구의 활성화 등의 이유, 또한 수술에 비해 비교적 손쉽게 할 수 있다는 이유로 경피적 카테터 절제술은 증가하고 있다[37]. 특히 다른 심장질환을 동반하지 않은 단독심방세동의 경우 환자와 의사 모두 경피적 시술을 선호하는 추세이다.
167명의 발작성 심방세동 환자에서 카테터 절제술과 내과적 치료(항부정맥제 또는 심박수 조절 치료)를 비교한 첫 무작위연구에서 12개월 추적관찰 결과, 카테터 절제술의 치료 성공률이 66%로 내과적 치료만 한 경우의 16%에 비해서 훨씬 우월하였다[38]. 또 다른 무작위 전향적 임상시험(Sustained Treatment of Paroxysmal Atrial Fibrillation trial)에서도 치료 성공률이 69.9% 대 7.3%로 역시 카테터 절제술이 내과적 치료에 비해 월등히 우수했지만, 기준 치료법으로 이미 입증된 메이즈에 비해서는 그 효과가 매우 떨어짐을 두 연구결과를 통해 확인할 수 있다[8,9,39].
Gammie 등[40]이 미국 흉부외과 협회(Society of Thoracic Surgeons)의 심장수술 데이터베이스를 바탕으로 한 부정맥수술 연구결과에 따르면, 심장수술 시 동반된 부정맥에 대한 수술적 치료를 받는 환자 수가 늘고는 있지만 여전히 60%에 가까운 환자들에서 부정맥에 대한 동반치료가 이루어지고 있지 않다. 또한 이 데이터베이스를 분석한 결과 승모판막 질환에 대한 수술환자에서 부정맥 수술의 동반이 수술의 위험도를 높이지 않는다고 보고하였다(Table 4) [40].
메이즈 수술이 카테터 절제술에 비해 우월한 효율성을 가지고 있다는 명백한 근거에도 불구하고 카테터 수술의 수는 증가하는 반면 비교적 적은 수의 환자에서만 부정맥 수술이 시행되고 있다는 사실은 많은 환자와 의사가 여전히 수술 자체에 대해 꺼린다는 것을 보여준다[10,37,40,41]. 이를 해결하기 위해서는 더욱 효율적이고 안전한 기구의 발전을 통해 최소 침습적인 수술의 발전이 필요할 것이다. 또한 침습적인 면을 따지기 이전에 환자의 임상적 결과에 초점을 맞추도록 하는 것이 중요하다. 심방세동의 기간, 좌심방 크기 등 심방세동의 수술적 치료 실패에 대한 정확한 평가와 계획에 따라 그 환자에 적절한 수술방법을 선택하는 것이 우선되어야 할 것이다.
심방세동의 수술적 치료에 있어서 새로운 기술의 발전에 따라 최소 침습적인 수술에 대한 관심이 높아지고 있으며 이를 위한 새로운 절제선 세트, 간편화된 기구 등도 지속적으로 발전하고 있다. 이에 더불어 카테터 절제술의 발전으로 단독심방세동의 수술적 치료에 대한 관심 또한 증가하고 있다. 하지만 심방세동의 수술적 치료에 있어 이러한 비침습적인 면이나 단순화된 면 등에 앞서 무엇보다 먼저 고려해야 할 점은, 심방세동 치료의 성공률과 치료 후 동률동을 장기간 유지하는 치료의 효율성, 생존율의 향상 및 주요 합병증 발생률 감소 등의 임상적 결과의 개선이다. 이런 점에서 결국 어떠한 새로운 기술의 발전도 콕스-메이즈 III를 근간으로 하는 수술적 치료를 재현하는 방향으로 발전해 갈 것이다. 더욱이 심방세동의 메커니즘에 대한 좀 더 많은 이해와 전기생리학적으로 심방세동의 발생하는 위치를 정확히 평가하는 진단기술의 발전으로 인해 개개인의 환자에 맞는 적절한 수술적 치료가 가능해질 것으로 전망된다.
심방세동의 수술적 치료는 1990년대부터 제시된 James Cox의 메이즈 수술이 2-3회의 수정을 거치면서 표준치료로 확립되었다. 본 원고는 심방세동의 수술적 치료에 대한 원리 및 발달과정과 최신경향에 대한 종합적인 기술과 더불어 심방세동의 보건학적, 역학적측면과 병태생리 등 기본적인 내용, 그리고 다양한 치료법의 현황을 기존에 보고된 연구와 자료를 근거로 체계적으로 기술하였다. 또한 최소침습수술법 등 최신 술기들을 적절히 소개하고 있으며, 변형메이즈 술식에 대해서도 간략히 기술하고 있다. 최근의 핫이슈로써 단독심방세동에 대한 최소침습수술법과 근거중심의학에 기초한 가이드라인 등을 소개하고, 장단점을 분석함으로써 더 나은 발전을 위한 방향제시를 했다는 점에서 의의가 있는 논문이라 판단된다.
[정리: 편집위원회]
References
1. Feinberg WM, Blackshear JL, Laupacis A, Kronmal R, Hart RG. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med 1995;155:469-473.


2. Friberg J, Scharling H, Gadsboll N, Jensen GB. Sex-specific increase in the prevalence of atrial fibrillation (The Copenhagen City Heart Study). Am J Cardiol 2003;92:1419-1423.


3. Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994;74:236-241.


4. Hart RG, Halperin JL. Atrial fibrillation and thromboembolism: a decade of progress in stroke prevention. Ann Intern Med 1999;131:688-695.


5. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham Study. Arch Intern Med 1987;147:1561-1564.


6. Cox JL. Atrial fibrillation I: a new classification system. J Thorac Cardiovasc Surg 2003;126:1686-1692.


7. Cox JL, Jaquiss RD, Schuessler RB, Boineau JP. Modification of the maze procedure for atrial flutter and atrial fibrillation. II. Surgical technique of the maze III procedure. J Thorac Cardiovasc Surg 1995;110:485-495.

8. Prasad SM, Maniar HS, Camillo CJ, Schuessler RB, Boineau JP, Sundt TM 3rd, Cox JL, Damiano RJ Jr. The Cox maze III procedure for atrial fibrillation: long-term efficacy in patients undergoing lone versus concomitant procedures. J Thorac Cardiovasc Surg 2003;126:1822-1828.


9. Cox JL. The central controversy surrounding the interventional-surgical treatment of atrial fibrillation. J Thorac Cardiovasc Surg 2005;129:1-4.


10. Calkins H, Kuck KH, Cappato R, Brugada J, Camm AJ, Chen SA, Crijns HJ, Damiano RJ Jr, Davies DW, DiMarco J, Edgerton J, Ellenbogen K, Ezekowitz MD, Haines DE, Haissaguerre M, Hindricks G, Iesaka Y, Jackman W, Jalife J, Jais P, Kalman J, Keane D, Kim YH, Kirchhof P, Klein G, Kottkamp H, Kumagai K, Lindsay BD, Mansour M, Marchlinski FE, McCarthy PM, Mont JL, Morady F, Nademanee K, Nakagawa H, Natale A, Nattel S, Packer DL, Pappone C, Prystowsky E, Raviele A, Reddy V, Ruskin JN, Shemin RJ, Tsao HM, Wilber D. Heart Rhythm Society Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design: a report of the Heart Rhythm Society (HRS) Task Force on Catheter and Surgical Ablation of Atrial Fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with the American College of Cardiology (ACC), American Heart Association (AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society of Thoracic Surgeons (STS). Endorsed by the governing bodies of the American College of Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society. Heart Rhythm 2012;9:632-696.e21.


11. Cox JL, Boineau JP, Schuessler RB, Ferguson TB Jr, Cain ME, Lindsay BD, Corr PB, Kater KM, Lappas DG. Successful surgical treatment of atrial fibrillation: review and clinical update. JAMA 1991;266:1976-1980.


13. Cox JL, Schuessler RB, D'Agostino HJ Jr, Stone CM, Chang BC, Cain ME, Corr PB, Boineau JP. The surgical treatment of atrial fibrillation. III. Development of a definitive surgical procedure. J Thorac Cardiovasc Surg 1991;101:569-583.

14. Castellá M, Garcia-Valentin A, Pereda D, Colli A, Martinez A, Martinez D, Ramirez J, Mulet J. Anatomic aspects of the atrioventricular junction influencing radiofrequency Cox maze IV procedures. J Thorac Cardiovasc Surg 2008;136:419-423.


15. Bum Kim J, Suk Moon J, Yun SC, Kee Kim W, Jung SH, Jung Choo S, Song H, Hyun Chung C, Won Lee J. Long-term outcomes of mechanical valve replacement in patients with atrial fibrillation: impact of the maze procedure. Circulation 2012;125:2071-2080.


16. Konings KT, Kirchhof CJ, Smeets JR, Wellens HJ, Penn OC, Allessie MA. High-density mapping of electrically induced atrial fibrillation in humans. Circulation 1994;89:1665-1680.


17. Moe GK, Rheinboldt WC, Abildskov JA. A computer model of atrial fibrillation. Am Heart J 1964;67:200-220.


18. Haïssaguerre M, Marcus FI, Fischer B, Clementy J. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases. J Cardiovasc Electrophysiol 1994;5:743-751.


19. Jongbloed MR, Schalij MJ, Poelmann RE, Blom NA, Fekkes ML, Wang Z, Fishman GI, Gittenberger-De Groot AC. Embryonic conduction tissue: a spatial correlation with adult arrhythmogenic areas. J Cardiovasc Electrophysiol 2004;15:349-355.

20. Zhou J, Scherlag BJ, Edwards J, Jackman WM, Lazzara R, Po SS. Gradients of atrial refractoriness and inducibility of atrial fibrillation due to stimulation of ganglionated plexi. J Cardiovasc Electrophysiol 2007;18:83-90.


21. Lee JW, Choo SJ, Kim KI, Song JK, Kang DH, Song JM, Song H, Lee SK, Song MG. Atrial fibrillation surgery simplified with cryoablation to improve left atrial function. Ann Thorac Surg 2001;72:1479-1483.


22. Kim JB, Bang JH, Jung SH, Choo SJ, Chung CH, Lee JW. Left atrial ablation versus biatrial ablation in the surgical treatment of atrial fibrillation. Ann Thorac Surg 2011;92:1397-1404.


23. Calò L, Lamberti F, Loricchio ML, De Ruvo E, Colivicchi F, Bianconi L, Pandozi C, Santini M. Left atrial ablation versus biatrial ablation for persistent and permanent atrial fibrillation: a prospective and randomized study. J Am Coll Cardiol 2006;47:2504-2512.

24. Scharf C, Veerareddy S, Ozaydin M, Chugh A, Hall B, Cheung P, Good E, Pelosi F Jr, Morady F, Oral H. Clinical significance of inducible atrial flutter during pulmonary vein isolation in pa tients with atrial fibrillation. J Am Coll Cardiol 2004;43:2057-2062.


25. Wolf RK, Schneeberger EW, Osterday R, Miller D, Merrill W, Flege JB Jr, Gillinov AM. Video-assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J Thorac Cardiovasc Surg 2005;130:797-802.


26. Shinbane JS, Lesh MD, Stevenson WG, Klitzner TS, Natterson PD, Wiener I, Ursell PC, Saxon LA. Anatomic and electrophysiologic relation between the coronary sinus and mitral annulus: implications for ablation of left-sided accessory pathways. Am Heart J 1998;135:93-98.


27. Edgerton JR, Jackman WM, Mack MJ. A new epicardial lesion set for minimal access left atrial maze: the Dallas lesion set. Ann Thorac Surg 2009;88:1655-1657.


28. Sirak J, Jones D, Schwartzman D. The five-box thoracoscopic maze procedure. Ann Thorac Surg 2010;90:986-989.


29. Balkhy HH, Chapman PD, Arnsdorf SE. Minimally invasive atrial fibrillation ablation combined with a new technique for thoracoscopic stapling of the left atrial appendage: case report. Heart Surg Forum 2004;7:353-355.


30. Pak HN, Hwang C, Lim HE, Kim JS, Kim YH. Hybrid epicardial and endocardial ablation of persistent or permanent atrial fibrillation: a new approach for difficult cases. J Cardiovasc Electrophysiol 2007;18:917-923.


31. Krul SP, Driessen AH, van Boven WJ, Linnenbank AC, Geuzebroek GS, Jackman WM, Wilde AA, de Bakker JM, de Groot JR. Thoracoscopic video-assisted pulmonary vein antrum isolation, ganglionated plexus ablation, and periprocedural confirmation of ablation lesions: first results of a hybrid surgical-electrophysiological approach for atrial fibrillation. Circ Arrhythm Electrophysiol 2011;4:262-270.

32. Eguchi K, Ohtaki E, Matsumura T, Tanaka K, Tohbaru T, Iguchi N, Misu K, Asano R, Nagayama M, Sumiyoshi T, Kasegawa H, Hosoda S. Pre-operative atrial fibrillation as the key determinant of outcome of mitral valve repair for degenerative mitral regurgitation. Eur Heart J 2005;26:1866-1872.


33. Doukas G, Samani NJ, Alexiou C, Oc M, Chin DT, Stafford PG, Ng LL, Spyt TJ. Left atrial radiofrequency ablation during mitral valve surgery for continuous atrial fibrillation: a randomized controlled trial. JAMA 2005;294:2323-2329.


34. Deneke T, Khargi K, Grewe PH, Laczkovics A, von Dryander S, Lawo T, Muller KM, Lemke B. Efficacy of an additional MAZE procedure using cooled-tip radiofrequency ablation in patients with chronic atrial fibrillation and mitral valve disease: a randomized, prospective trial. Eur Heart J 2002;23:558-566.


35. Abreu Filho CA, Lisboa LA, Dallan LA, Spina GS, Grinberg M, Scanavacca M, Sosa EA, Ramires JA, Oliveira SA. Effectiveness of the maze procedure using cooled-tip radiofrequency ablation in patients with permanent atrial fibrillation and rheumatic mitral valve disease. Circulation 2005;112:9 Suppl. I20-I25.


36. Budera P, Straka Z, Osmancik P, Vanek T, Jelinek S, Hlavicka J, Fojt R, Cervinka P, Hulman M, Smid M, Maly M, Widimsky P. Comparison of cardiac surgery with left atrial surgical ablation vs. cardiac surgery without atrial ablation in patients with coronary and/or valvular heart disease plus atrial fibrillation: final results of the PRAGUE-12 randomized multicentre study. Eur Heart J 2012;33:2644-2652.



37. Cappato R, Calkins H, Chen SA, Davies W, Iesaka Y, Kalman J, Kim YH, Klein G, Natale A, Packer D, Skanes A, Ambrogi F, Biganzoli E. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010;3:32-38.


38. Packer DL, Kowal RC, Wheelan KR, Irwin JM, Champagne J, Guerra PG, Dubuc M, Reddy V, Nelson L, Holcomb RG, Lehmann JW, Ruskin JN. STOP AF Cryoablation Investigators. Cryoballoon ablation of pulmonary veins for paroxysmal atrial fibrillation: first results of the North American Arctic Front (STOP AF) pivotal trial. J Am Coll Cardiol 2013;61:1713-1723.

39. Wilber DJ, Pappone C, Neuzil P, De Paola A, Marchlinski F, Natale A, Macle L, Daoud EG, Calkins H, Hall B, Reddy V, Augello G, Reynolds MR, Vinekar C, Liu CY, Berry SM, Berry DA. ThermoCool AF Trial Investigators. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA 2010;303:333-340.

Figure 1
The traditional cut-and-sew Cox-Maze III procedure (From Cox JL, et al. J Thorac Cardiovasc Surg 1991;101:569-583, with permission from Elsevier) [13].
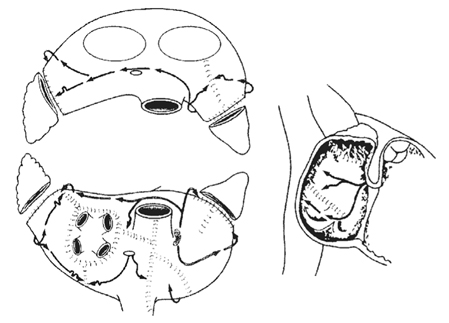
Figure 2
Structure and mechanisms of atrial fibrillation. (A) Schematic drawing of the left and right atria as viewed from the posterior. The extension of muscular fibers onto the pulmonary veins can be appreciated. Shown in yellow are the five major left atrial autonomic ganglionic plexi and axons. Shown in blue is the coronary sinus, which is enveloped by muscular fibers that have connections to the atria. Also shown in blue is the vein and ligament of Marshall, which travels from the coronary sinus to the region between the left superior pulmonary vein (LSPV) and the left atrial appendage. (B) The large and small reentrant wavelets that play a role in initiating and sustaining atrial fibrillation. (C) The common locations of pulmonary veins (red) and also the common sites of origin of non-pulmonary vein triggers (green). (D) Composite of the anatomic and arrhythmic mechanisms of atrial fibrillation. SVC, superior vena cava; RSPV, right superior pulmonary vein; LIPV, left inferior pulmonary vein; RIPV, right inferior pulmonary vein; IVC, inferior vena cava (From Calkins H, et al. Heart Rhythm 2012;9: 632.e21-696.e21, with permission from Elsevier) [10].
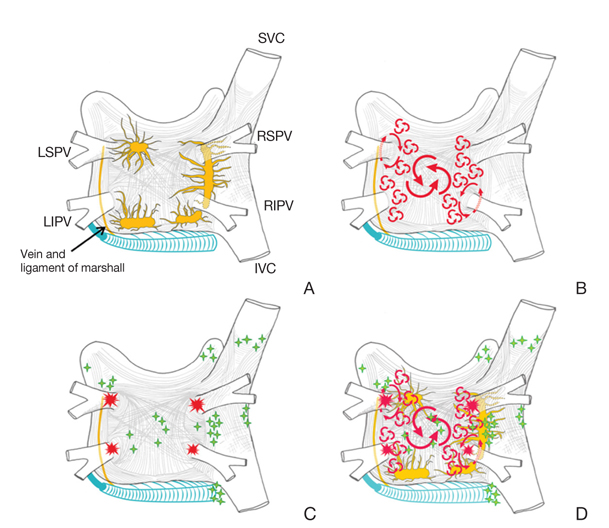
Figure 3
Similar line patterns, different type of lesions. (A), (B), and (C) show the lines described by Cox in the cut-and-sew Cox-Maze III. (D), (E), and (F) show pattern for a Cox-Maze IV, combining incisions and bipolar radifrequency ablation (dotted lines). LAA, left atrial appendage; MV, mitral valve; CS, coronary sinus (From Castella M, et al. J Thorac Cardiovasc Surg 2008;136:419-423, with permission from Elsevier) [14].
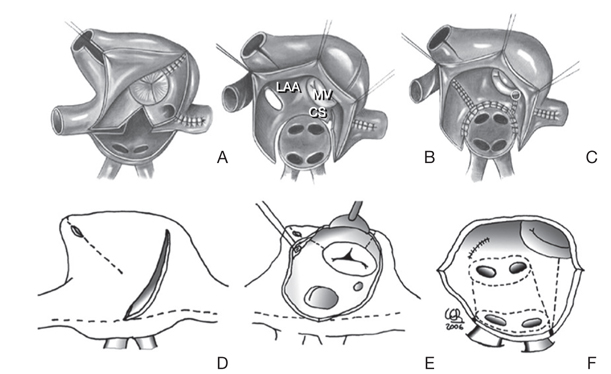
Figure 4
Diagram of the left atrial (A) and right atrial (B) ablation procedures using cryoablation (dotted lines). SVC, superior vena cava; LAA, left atrial appendage; PV, pulmonary vein; MV, mitral valve; IVC, inferior vena cava; RAA, right atrial appendage; TV, tricuspid valve; CS, coronary sinus (From Kim JB, et al. Ann Thorac Surg 2011;92:1397-1404, with permission from Elsevier) [22].

Figure 5
The Dallas epicardial lesion set for minimal access left atrial maze. 1, 2 and 3 indicates position of the temporary pacing and recording electrodes for intraoperative physiological evaluation to insure complete isolation across each lesion line. LAA, left atrial appendage; PV, pulmonary vein; LA, left atrial (From Edgerton JR, et al. Ann Thorac Surg 2009;88:1655-1657, with permission from Elsevier) [27].
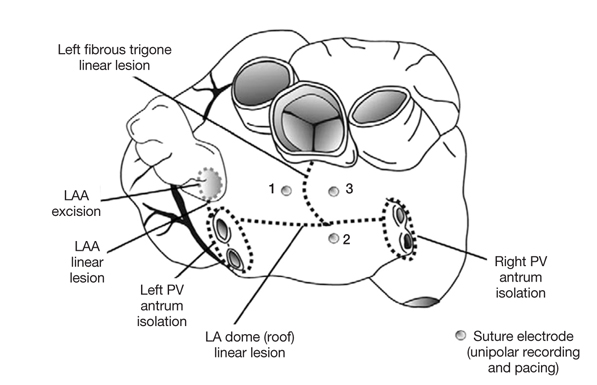
Figure 6
A significant difference in cardiac event-free rate was observed between patients with preoperative sinus rhythm and atrial fibrillation (AF) undergoing degenerative mitral valve repair. SR, sinus rhythm; HR, hazard ratio (From Eguchi K, et al. Eur Heart J 2005;26:1866-1872, with permission from Elsevier) [32].
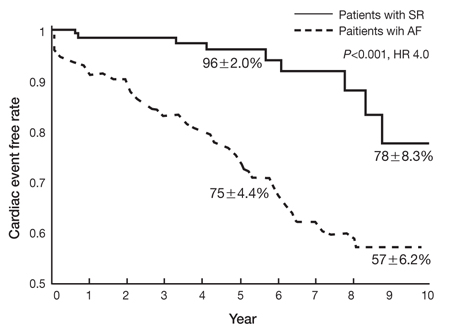
Table 1
Consensus indications for surgical ablation of AF (2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation)

From Calkins H, et al. Heart Rhythm 2012;9:632.e21-696.e21, with permission from Elsevier [10].
AF, atrial fibrillation.
Table 2
Recommendations regarding ablation technique

From Calkins H, et al. Heart Rhythm 2012;9:632.e21-696.e21, with permission from Elsevier [10].
PV, pulmonary vein; AF, atrial fibrillation; RF, radiogrequency.
Table 3
Summary of results of randomized clinical trials on concomitant AF ablation at the time of cardiac surgery
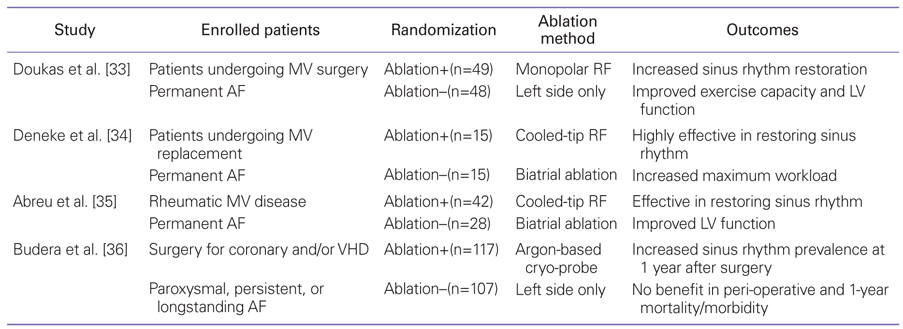
Table 4
Standardized outcome rates stratified using ten propensity subclasses

From Gammie JS, et al. Ann Thorac Surg 2008;85:909-914, with permission from Elsevier [40].
STAF, surgical treatment of atrial fibrillation; LOS, length of stay.
- TOOLS
-
METRICS

-
Related articles in
J Korean Med Assoc -
Surgical treatment and recurrence of chronic subdural hematoma2024 June;67(6)
Medical treatment of pediatric obesity2024 May;67(5)
Surgical treatment of esophageal cancer2024 February;67(2)
Diagnosis and treatment of dysphagia2023 October;66(10)
Diagnosis and treatment of adult spinal deformity2023 August;66(8)





